题目内容
9.NiSO4•6H2O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下: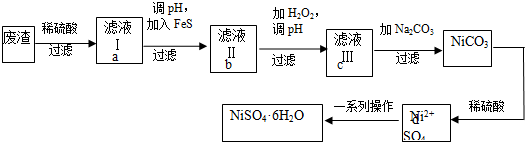
(1)向滤液Ⅰ中加入FeS是为了生成难溶于酸的硫化物沉淀而除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为:FeS+Cu2+=CuS+Fe2+.
(2)对滤液Ⅱ的操作,请回答:
①往滤液Ⅱ中加入H2O2的离子方程式:2Fe2++H2O2+2H+=2Fe3++2 H2O.
②调滤液ⅡpH的目的是除去Fe3+.
③检验Fe3+是否除尽的操作和现象是:用试管取少量滤液Ⅲ,滴加几滴KSCN溶液,若无颜色变化,则Fe3+已除净.
(3)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4).
(4)得到的NiSO4溶液经蒸发浓缩、冷却结晶、过滤等一系列操作可得到NiSO4•6H2O晶体,请回答:
①在进行蒸发浓缩操作时,加热到液表面形成晶体薄膜(或者有少量晶体析出)(描述实验现象),则停止加热.
②为了提高产率,过滤后得到的母液要循环使用,则应该回流到流程中的d位置.(填a、b、c、d)
③如果得到产品的纯度不够,则应该进行重结晶操作(填操作名称).
分析 废渣(除含镍外,还含有Cu、Zn、Fe等元素的化合物杂质),在硫酸溶解后过滤后除去不溶性物质,滤液Ⅰ含有二价铁离子、镍离子、锌离子等杂质,加入硫化钠可除去铜离子、锌离子,然后加H2O2是将二价铁氧化成三价铁,调节溶液PH使三价铁以氢氧化物的沉淀而除去,滤液Ⅲ含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4晶体,
(1)FeS除去Cu2+的反应是沉淀的转化;
(2)①对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+;
②然后调pH沉淀Fe3+,Fe3++3H2O?Fe(OH)3+3H+;
③依据铁离子遇到KSCN溶液呈红色设计实验检验是否除净;
(3)NiSO4与Na2CO3反应生成NiCO3沉淀,而后过滤,再加适量稀硫酸溶解又生成NiSO4,这样可提高NiSO4的浓度,有利于蒸发结晶;
(4)①在进行蒸发浓缩操作时,当大量晶体析出时,停止加热;
②为了提高产率,过滤后得到的母液要循环使用,应该回流到流程中d中;
③产品的纯度不够需要重新溶解、浓缩、结晶析出得到较纯净的晶体;
解答 解:废渣(除含镍外,还含有Cu、Zn、Fe等元素的化合物杂质),在硫酸溶解后过滤后除去不溶性物质,滤液Ⅰ含有二价铁离子、镍离子、锌离子等杂质,加入硫化钠可除去铜离子、锌离子,然后加H2O2是将二价铁氧化成三价铁,调节溶液PH使三价铁以氢氧化物的沉淀而除去,滤液Ⅲ含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4晶体,
(1)FeS除去Cu2+的反应是沉淀的转化,即FeS+Cu2+=CuS+Fe2+;
故答案为:FeS+Cu2+=CuS+Fe2+;
(2)①对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+,加入H2O2的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2 H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2 H2O;
②调滤液ⅡpH的目的是除去Fe3+,
故答案为:除去Fe3+;
③检验Fe3+是否除尽的操作和现象是用试管取少量滤液Ⅲ,滴加几滴KSCN溶液,若无颜色变化,则Fe3+已除净;
故答案为:用试管取少量滤液Ⅲ,滴加几滴KSCN溶液,若无颜色变化,则Fe3+已除净;
(3)NiSO4与Na2CO3反应生成NiCO3沉淀,而后过滤,再加适量稀硫酸溶解又生成NiSO4,这样可提高NiSO4的浓度,有利于蒸发结晶;
故答案为:增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4);
(4)①在进行蒸发浓缩操作时,当大量晶体析出时或溶液表面形成晶体薄膜,停止加热;
故答案为:溶液表面形成晶体薄膜或者有大量晶体析出;
②为了提高产率,过滤后得到的母液要循环使用,应该回流到流程中d中循环使用,故答案为:d;
③产品的纯度不够需要重新溶解、浓缩、结晶析出得到较纯净的晶体,实验操作为重结晶,故答案为:重结晶.
点评 本题考查物质的分离提纯的实验方案的设计,侧重于学生的分析能力和实验能力的考查,题目难度较大,明确实验的目的和原理是解答该题的关键,注意把握基本实验操作.

| A. | Zn 具有导电性,用作锌锰干电池的负极材料 | |
| B. | 锌的金属活泼性比铁的强,可在海轮外壳上装若干锌板以减缓其腐蚀 | |
| C. | NaHCO3受热能分解产生CO2气体,在食品工业中可作为焙制糕点的膨忪剂 | |
| D. | 常温下浓硫酸能使铝发生钝化,常温下可用铝制容器贮藏贮运浓硫酸 |
| A. | 0.2mol | B. | 0.4mol | C. | 0.6mol | D. | 0.8mol |

(1)工业生产硫酸的第一步反应如下,请配平该化学方程式并用单线桥法标注电子转移的方向和数目:
4FeS2+11O2$\frac{高温}{\;}$8SO2+2Fe2O3
(2)写出生产过程中XFe,YHCl (填化学式).
(3)产生CuCl的化学方程式CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(4)氯化亚铜的定量分析:
①称取样品0.25g 置于预先放入10mL过量的eCl3溶液250mL的锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.10 mol•L-1硫酸铈Ce(SO4)2标准溶液滴至绿色出现为终点.如此再重复二次测得数据如下:
( 已知:CuCl+FeCl3 ══CuCl2 +FeCl2 Fe2++Ce4+══Fe3++Ce3+)
| 1 | 2 | 3 | |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 23.85 | 24.35 | 23.95 |
| A. | 用碳酸钠溶液可以洗涤油污 | B. | 用pH试纸可以测定土壤的酸碱性 | ||
| C. | 用明矾可以对自来水杀菌病毒 | D. | 含氟牙膏可以有效防止龋齿 |
| A. | X的氢化物的水溶液呈酸性 | |
| B. | Y的氧化物和氢氧化物均不溶于水 | |
| C. | Z的最高价含氧酸的浓溶液有强氧化性 | |
| D. | W原子半径在同周期中最小 |
| A. | 甲烷和氯气光照条件下反应,反应类型为取代反应;乙烯可以使溴水褪色,发生加成反应 | |
| B. | 不能用酸性高锰酸钾溶液鉴别乙酸和乙醇 | |
| C. | 乙醇在铜做催化剂并加热条件下生成乙醛,发生催化氧化反应 | |
| D. | 生活中可以用食醋除去水壶中的水垢,主要是利用了食醋中醋酸的酸性 |


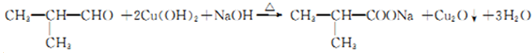 .
. .
.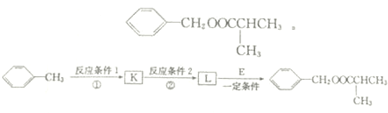 反应②所选用的试剂为氢氧化钠溶液,L的结构简式为
反应②所选用的试剂为氢氧化钠溶液,L的结构简式为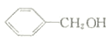 .
.