题目内容
14.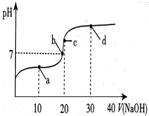 常温下,向20mL 0.1mol/L 醋酸溶液中滴加0.1mol/L NaOH溶液,溶液的pH变化如图所示.下列关于溶液中微粒浓度大小关系说法正确的是( )
常温下,向20mL 0.1mol/L 醋酸溶液中滴加0.1mol/L NaOH溶液,溶液的pH变化如图所示.下列关于溶液中微粒浓度大小关系说法正确的是( )| A. | a点时:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | b点时:c(Na+)=c(CH3COO-)>c(H+)=c(OH-) | |
| C. | c点时:c(H+)=c(CH3COOH)+c(OH-) | |
| D. | d点时:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
分析 A.a点是醋酸过量,反应后生成等浓度的醋酸和醋酸钠,醋酸的电离程度大于醋酸根离子的水解程度,混合液呈酸性,结合物料守恒及电荷守恒判断各离子浓度大小;
B.b点时溶液为中性,则c(H+)=c(OH-),根据电荷守恒可知:c(Na+)=c(CH3COO-);
C.c点时恰好反应生成醋酸钠,根据醋酸钠溶液中的质子守恒判断;
D.d点时加入30ml氢氧化钠溶液,则溶质为醋酸钠和氢氧化钠的混合物,混合液中醋酸钠的浓度为0.4mol/L,氢氧化钠的浓度为0.2mol/L,结合醋酸根离子水解程度较小判断各离子浓度大小.
解答 解:A.a点时醋酸过量,溶质为等浓度的CH3COOH和CH3COONa的混合物,溶液呈酸性,醋酸根离子的水解程度小于醋酸的电离程度,则醋酸根离子浓度增大,故c(CH3COO-)>c(CH3COOH),结合物料守恒可知c(CH3COOH)>c(Na+)>c(CH3COO-),所以溶液中离子浓度大小为:c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-),故A正确;
B.b点时溶液的pH=7,则溶液呈中性:c(H+)=c(OH-),根据溶液电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)可知:c(Na+)=c(CH3COO-),溶液中离子浓度关系为:c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故B正确;
C.c点时,氢氧化钠与醋酸恰好反应生成醋酸钠溶液,根据醋酸钠溶液中的质子守恒可知:c(OH-)=c(CH3COOH)+c(H+),故C错误;
D.d点为NaOH和CH3COONa的混合物,氢氧化钠过量,溶液呈碱性,其中醋酸钠的浓度为0.4mol/L,氢氧化钠的浓度为0.2mol/L,由于CH3COO-的水解程度较小,则c(CH3COO-)>c(OH-),溶液中离子浓度大小为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D错误;
故选AB.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确各点反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及质子守恒在判断离子浓度大小中的应用方法.

 名校课堂系列答案
名校课堂系列答案| A. | Cl2 | B. | H2O | C. | CO2 | D. | NaCl |
| A. | 碘升华 | B. | 二氧化氮被木炭吸附 | ||
| C. | HCl气体溶于水 | D. | 酒精溶于水 |
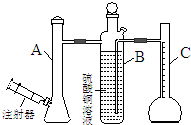
| A. | 反应前后抽气使B中导管内外液面持平 | |
| B. | 用饱和食盐水代替A装置中的蒸馏水 | |
| C. | 把A装置浸入盛有冰水混合物的水槽中 | |
| D. | 在B装置中的硫酸铜溶液表面覆盖一层苯 |
| A. | Zn 具有导电性,用作锌锰干电池的负极材料 | |
| B. | 锌的金属活泼性比铁的强,可在海轮外壳上装若干锌板以减缓其腐蚀 | |
| C. | NaHCO3受热能分解产生CO2气体,在食品工业中可作为焙制糕点的膨忪剂 | |
| D. | 常温下浓硫酸能使铝发生钝化,常温下可用铝制容器贮藏贮运浓硫酸 |
| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | 氨水吸收足量的SO2气体:NH3•H2O+SO2═NH4++HSO3- | |
| C. | 少量SO2通入NaClO溶液中:SO2+ClO-+H2O═SO42-+Cl-+2H+ | |
| D. | 向Fe(OH)3悬浊液中加入氢碘酸:Fe(OH)3+3H+═Fe3++3H2O |
| A. | HCl、N2、NH3 | B. | Cl2、CO2、O2 | C. | NO、O2、N2 | D. | SO2、CO、H2S |
| A. | 用碳酸钠溶液可以洗涤油污 | B. | 用pH试纸可以测定土壤的酸碱性 | ||
| C. | 用明矾可以对自来水杀菌病毒 | D. | 含氟牙膏可以有效防止龋齿 |