题目内容
【题目】I.现有三个反应:
反应①![]()
![]() =a kJ/mol平衡常数为K1
=a kJ/mol平衡常数为K1
反应②![]()
![]() 平衡常数为K2
平衡常数为K2
反应③![]()
![]() =b kJ/mol平衡常数为K3
=b kJ/mol平衡常数为K3
在不同温度下,部分K1、K2的值如下:
T/℃ | 700 | 800 |
K1 | 2.38 | 2.56 |
K2 | 0.80 |
(1) ![]()
![]() ==____________________
==____________________
(2)K1的表达式为____________;根据反应①、②、③推导出K1、K2、K3的关系式K3=______________。
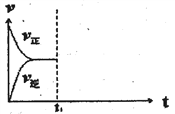
(3)在恒温恒压密闭容器中通入CO和H2O各1mol发生反应②,当反应达到平衡后,维持温度与压强不变,t1时再通入各1mol的CO和H2O的混合气体,请在下图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图_______。
Ⅱ.在容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入同量的NOx及C3H6,在不同温度下,同时发生以下反应:
18NO(g)+2C3H6(g) 9N2(g)+6CO2(g)+6H2O(g):
18NO2(g)+4C3H6(g) 9N2(g)+12CO2(g)+12H2O(g);
并分别在t秒时测定其中NOx转化率,绘得图像如下图所示:
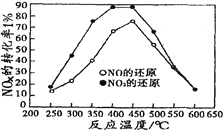
①从图中可以得出的结论是
结论一:从测定NOx转化数据中判断,相同温度下NO转化效率比NO2的低。
结论二:________________________________________________________
②在上述NO2和C3H6反应中,提高NO2转化率的措施有_____________。(填编号)
A.加入催化剂 B.降低温度 C.分离出H
Ⅲ.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.6,c(H2CO3)=1.5×10 -5 mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3-+ H+ 的平衡常数K1=___________。(已知:10-5.60=2.5×10-6 )
【答案】 (a-b) kJ/mol ![]()
![]()
 在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小(或450℃,NOx与C3H6的反应达到平衡,且正反应是放热反应) BC 4.2×10-7 mol/L
在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小(或450℃,NOx与C3H6的反应达到平衡,且正反应是放热反应) BC 4.2×10-7 mol/L
【解析】 (1) 反应①![]()
![]() =a kJ/mol,反应③
=a kJ/mol,反应③![]()
![]() =b kJ/mol,根据盖斯定律,将①-③得:
=b kJ/mol,根据盖斯定律,将①-③得: ![]()
![]() =(a-b) kJ/mol,故答案为:(a-b) kJ/mol;
=(a-b) kJ/mol,故答案为:(a-b) kJ/mol;
(2)K1的表达式为![]() ;将方程式①-②得方程式③,则K3=
;将方程式①-②得方程式③,则K3=![]() ;故答案为:
;故答案为: ![]() ;
; ![]() ;
;
(3)由于该反应是前后体积不变的反应,在恒压条件下,再通入各1mol的CO和H2O的混合气体,与起始量之比相同,平衡后与原平衡为等效平衡,在增加反应物的开始,容器体积增大,反应物浓度增大,生成物浓度变小,所以正反应速率变大,逆反速率减小,但最终平衡不移动,据此画出图为 ,故答案为:
,故答案为: ;
;
Ⅱ.①通过图像知,NO转化效率比NO2的低;在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小,故答案为:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小;
②根据图像知,温度越高(450℃),二氧化氮的转化率越小,所以该反应是放热反应,且该反应是气体体积增大的反应。A、催化剂只改变反应到达平衡的时间,不改变化学平衡状态,故A错误;B、该反应是放热反应,所以降低温度,平衡向正反应方向移动,增大二氧化氮的转化率,故B正确;C、分离出H2O(g),减少生成物的浓度,平衡向正反应方向移动,增大二氧化氮的转化率,故C正确;D、该反应是气体体积增大的反应,增大压强,平衡向逆反应方向移动,二氧化氮的转化率降低,故D错误;故答案为:BC;
Ⅲ.饱和CO2水溶液的pH=5.60,所以c(H+)=10-5.6=2.5×10-6mol/L,c(H2CO3)=1.5×10-5molL-1,H2CO3的第一级电离方程式为:H2CO3HCO3-+H+,H2CO3的第一级电离的平衡常数K1=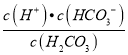 =
=![]() =4.2×10-7 mol/L,故答案为:4.2×10-7 mol/L。
=4.2×10-7 mol/L,故答案为:4.2×10-7 mol/L。

【题目】已知H2CO3和H2SO3的电离常数如下表:
酸 | Ka1 | Ka2 |
H2CO3 | 4.27×10-7 | 5.61×10-11 |
H2SO3 | 1.54×10-2 | 1.02×10-7 |
向10mL0.1mol/LNa2CO3溶液中滴加0.1mol/LH2SO3溶液,测得溶液pH随加入H2SO3溶液体积的变化如图所示。
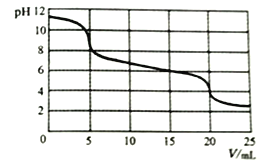
下列说法不正确的是
A. 加入H2SO3溶液前,Na2CO3溶液中:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
B. 0<V<5时,溶液中反应为:H2SO3+CO32-==HCO3-+HSO3-
C. 15<V<20时,溶液中反应为:H2SO3+HCO3-==HSO3-+CO2↑+H2O
D. V=15时,所得溶液中:(HCO3-)<c(HSO3-)







