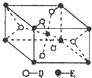
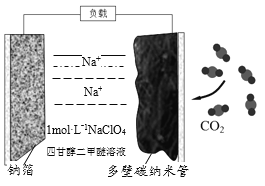
题目内容
【题目】常温下,HX溶液、HY溶液、HY和NaY的混合溶液,分别加水稀释,稀释后溶液的pH随浓度的变化如图所示,下列叙述正确的是
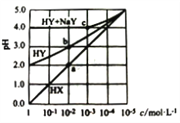
A. HX、HY均为一元强酸
B. 溶液中水的电离程度:a = b < c
C. 常温下,HY的电离常数Ka约为1.0×10-4
D. c点溶液:c(Na+)>c(Y-)>c(HY) >c(H+)>c(OH-)
【答案】C
【解析】A.图像中1.0mol/L的HX溶液pH=0说明HX为强酸,1.0mol/L的HY溶液pH=2说明HY为弱酸,故A错误;B.HX为强酸,HY为弱酸,加水稀释相同倍数,a点HX溶液中氢离子浓度大于b点HY,溶液中水的电离程度:a点小于b点,故B错误;C.1.0mol/LHY溶液pH=2,c(H+)=10-2mol/L,结合定量平衡常数K=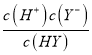 =
=![]() ≈1×10-4,故C正确;D.HY和NaY的混合溶液,溶液pH=4,根据C的计算,有K=
≈1×10-4,故C正确;D.HY和NaY的混合溶液,溶液pH=4,根据C的计算,有K=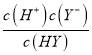 =
=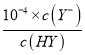 ≈1×10-4,此时c(Y-)=c(HY)= c(Na+),加水稀释后溶液仍显酸性,HY电离程度大于Y-离子水解程度,因此c点溶液中离子浓度大小,c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-),故D错误;故选C。
≈1×10-4,此时c(Y-)=c(HY)= c(Na+),加水稀释后溶液仍显酸性,HY电离程度大于Y-离子水解程度,因此c点溶液中离子浓度大小,c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-),故D错误;故选C。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案 培优三好生系列答案
培优三好生系列答案【题目】I.现有三个反应:
反应①![]()
![]() =a kJ/mol平衡常数为K1
=a kJ/mol平衡常数为K1
反应②![]()
![]() 平衡常数为K2
平衡常数为K2
反应③![]()
![]() =b kJ/mol平衡常数为K3
=b kJ/mol平衡常数为K3
在不同温度下,部分K1、K2的值如下:
T/℃ | 700 | 800 |
K1 | 2.38 | 2.56 |
K2 | 0.80 |
(1) ![]()
![]() ==____________________
==____________________
(2)K1的表达式为____________;根据反应①、②、③推导出K1、K2、K3的关系式K3=______________。
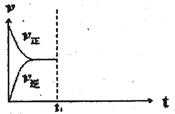
(3)在恒温恒压密闭容器中通入CO和H2O各1mol发生反应②,当反应达到平衡后,维持温度与压强不变,t1时再通入各1mol的CO和H2O的混合气体,请在下图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图_______。
Ⅱ.在容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入同量的NOx及C3H6,在不同温度下,同时发生以下反应:
18NO(g)+2C3H6(g) 9N2(g)+6CO2(g)+6H2O(g):
18NO2(g)+4C3H6(g) 9N2(g)+12CO2(g)+12H2O(g);
并分别在t秒时测定其中NOx转化率,绘得图像如下图所示:
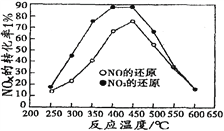
①从图中可以得出的结论是
结论一:从测定NOx转化数据中判断,相同温度下NO转化效率比NO2的低。
结论二:________________________________________________________
②在上述NO2和C3H6反应中,提高NO2转化率的措施有_____________。(填编号)
A.加入催化剂 B.降低温度 C.分离出H
Ⅲ.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.6,c(H2CO3)=1.5×10 -5 mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3-+ H+ 的平衡常数K1=___________。(已知:10-5.60=2.5×10-6 )