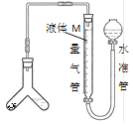
题目内容
【题目】利用如图所示装置,以NH3作氢源,可实现电化学氢化反应。下列说法错误的是

A.a为阴极
B.b电极反应为:2NH3-6e-=N2+6H+
C.电解一段时间后,装置内H+数目增多
D.理论上每消耗1 mol NH3,可生成1.5mol![]()
【答案】C
【解析】
根据图像可知,b极氨气中的N原子化合价由-3变为0价,得电子为电解池的阳极,则b极为阴极,化合价降低得电子;电解质溶液中的氢离子向阴极移动;
A.分析可知, a为阴极得电子,A正确;
B. b电极氨气中的N原子化合价由-3变为0价,生成氮气和氢离子,其电极反应为:2NH3-6e-=N2+6H+,B正确;
C. 电解一段时间后,b电极消耗溶液中的氢离子,装置内H+数目不变,C错误;
D. 理论上每消耗1 mol NH3,消耗溶液中3mol氢离子,发生加成反应,可生成1.5mol![]() ,D正确;
,D正确;
答案为C

练习册系列答案
 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目