题目内容
8.反应NO2(g)+CO(g)=NO(g)+CO2(g)△H=+234kJ•mol-1的反应机理为:2NO2=NO3+NO(慢) NO2+CO=NO2+CO2(快)下列有关该反应的说法正确的是( )| A. | 正反应的活化能比逆反应的活化能大234kJ•mol-1 | |
| B. | NO3是该反应的催化剂 | |
| C. | 化学反应速率v(NO2)=2v(CO) | |
| D. | 过程1和过程2均为放热反应 |
分析 A.正反应△H=+234kJ•mol-1,为吸热反应;
B.NO3是中间产物;
C.化学反应速率之比等于化学计量数之比;
D.该反应为吸热反应.
解答 解:A.某反应的△H=+234kJ•mol-1,则正反应的活化能-逆反应的活化能=234kJ•mol-1,故A正确;
B.NO3是中间产物,不是催化剂,故B错误;
C.化学反应速率之比等于化学计量数之比,v(NO2)=v(CO),故C错误;
D.过程1和过程2均放热,总反应不可能为吸热反应,故D错误.
故选A.
点评 本题考查了反应焓变的含义和计算、催化剂等,注意过程1和过程2均放热,总反应不可能为吸热反应,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.元素周期表中某区域的一些元素多用于制造半导体材料,它们是( )
| A. | 稀有气体元素 | |
| B. | 左、下方区域的金属元素 | |
| C. | 右、上方区域的非金属元素 | |
| D. | 金属元素和非金属元素分界线附近的元素 |
19.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、Cl- | |
| D. | pH=12的溶液:K+、Na+、CH3COO-、Br- |
16.下列有关化学概念或原理的论述中正确的是( )
| A. | 由SO2通入Ba(NO3)2溶液产生白色沉淀可知,BaSO3不溶于硝酸 | |
| B. | 电解精炼铜,电解结束后电解质溶液浓度不变 | |
| C. | 海水中Na+、Cl一结晶成NaCl的过程,形成了化学键 | |
| D. | 任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
3.下列操作和现象与结论均正确的是( )
| 选项 | 操作 | 现象 | 结论 |
| A | 向盐酸酸化的Ba(NO3)2溶液中通入SO2 | 有白色沉淀生成 | BaSO3难溶于酸 |
| B | 向等浓度的KCl、Kl混合液中滴加AgNO3溶液 | 先出现白色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 溴乙烷与NaOH水溶液共热后,加HNO3酸化,滴加AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷含溴元素 |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| A. | A | B. | B | C. | C | D. | D |
18.下列有关溶液组成的描述合理的是( )
| A. | 无色溶液中可能大量存在Al3+、NH4+、Na+、Cl?、S2?、AlO2- | |
| B. | c(H+):c(OH-)=1:1012的溶液中Mg2+、Cu2+、Fe2+、SO42-、Cl?、NO3-可以大量共存 | |
| C. | pH=8的溶液中可能大量存在Na+、K+、Ba2+、Cl-、HCO3-、NO3- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Al3+、Cl-、SO42-、NO3- |
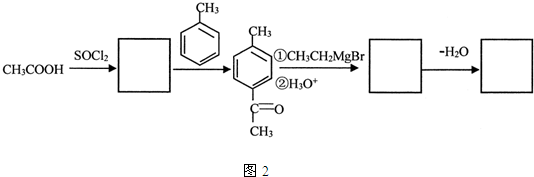
 ,
,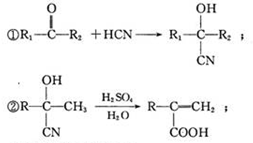
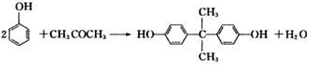 .
. )结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的异构体共有8种(不考虑立体异构),其中核磁共振氢谱有8组峰的是
)结构,萘环上只有1个取代基且水解产物之一能与FeCl3溶液发生显色反应的异构体共有8种(不考虑立体异构),其中核磁共振氢谱有8组峰的是 (写出其中一种的结构简式).
(写出其中一种的结构简式).
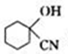 .
.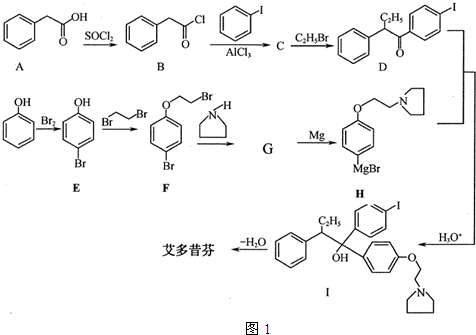
 ; 艾多昔芬
; 艾多昔芬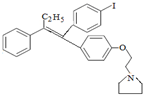 .
.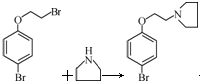 +HBr
+HBr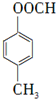 .
.