题目内容
【题目】“84消毒液”能有效杀灭甲型H1N1病毒,某同学购买了一瓶“威露士”牌“84消毒液”,并查阅相关资料和消毒液包装说明得到如下信息:“84消毒液”:含25%NaClO、1 000 mL、密度1.192 g·cm3,稀释100倍(体积比)后使用。请根据以上信息和相关知识回答下列问题:
(1)该“84消毒液”的物质的量浓度为________mol·L1。
(2)该同学取100 mL“威露士”牌“84消毒液”稀释后用于消毒,稀释后的溶液中c(Na+)=________mol·L1。
(3)一瓶“威露士”牌“84消毒液”能吸收空气中________L的CO2(标准状况)而变质。(已知:CO2+2NaClO+
H2O![]() Na2CO3+2HClO)
Na2CO3+2HClO)
(4)该同学参阅“威露士”牌“84消毒液”的配方,欲用NaClO固体配制480 mL含25%NaClO的消毒液。下列说法正确的是________。
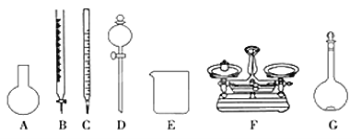
A.如上图所示的仪器中,有四种是不需要的,还需一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干才能用于溶液配制
C.利用购买的商品NaClO来配制可能导致结果偏低
D.需要称量的NaClO固体质量为143 g
【答案】(1)4.0(2分)
(2)0.04(3分)
(3)44.8(3分)
(4)C(3分)
【解析】(1)根据c=1000ρw/M,则c(NaClO)=1000 mL×1.192 g·cm3×25%/(74.5 g/mol×1 L)=4.0 mol·L1。
(2)根据稀释前后溶质的物质的量不变,则100 mL×4.0 mol·L1=(100 mL×1.19 g·cm3+10000 g)/11 g·cm3×c(NaClO)解得稀释后c(NaClO)≈0.04 mol·L1,c(Na+)=c(NaClO)≈0.04 mol·L1。
(3)一瓶“84消毒液”含有n(NaClO)=1 L×4.0 mol·L1=4.0 mol,根据反应CO2+2NaClO+H2O![]() Na2CO3+
Na2CO3+
2HClO,则需要n(CO2)=n(NaClO)×1/2=2.0 mol,即标准状况下V(CO2)=2.0 mol×22.4 L·mol1=44.8 L。
(4)A、需用托盘天平称量NaClO固体,需用烧杯来溶解NaClO,需用玻璃棒进行搅拌和引流,需用容量瓶和胶头滴管来定容,图示的A、B、C、D不需要,但还需玻璃棒和胶头滴管,故A错误;B、配制过程中需要加入水,所以经洗涤干净的容量瓶不必烘干后再使用,故B错误;C、由于NaClO易吸收空气中的H2O、CO2而变质,所以商品NaClO可能部分变质导致NaClO减少,配制的溶液中溶质的物质的量减小,结果偏低,故C正确;D、应选取500 mL的容量瓶进行配制,然后取出480 mL即可,所以需要NaClO的质量:0.5 L×4.0 mol·L1×74.5 g·mol1=149 g,故D错误。

【题目】《石雅》云:“青金石色相如天,或复金屑散乱,光辉灿烂,若众星丽于天也。”天为上,所以中国古代通常称青金石为帝王石,明淸尤重。青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素。
(1)铝元素基态原子的外围电子轨道表示式为_____________,基态硅原子核外电子占有的原子轨道数为_____________个,氧、硫、氯的第一电离能由大到小顺序为________________。
(2)SCl2分子中的中心原子杂化轨道类型是_____________,该分子空间构型为__________。
(3)第四周期中,与氯原子未成对电子数相同的金属元素有_______种。
(4)晶体硅的结构与金刚石非常相似。金刚石、晶体硅和金刚砂(碳化硅)的熔点由高到低的顺序为____________(填化学式)。
(5)下表是一组物质的沸点数据:
有机物 | 甲醇(CH3OH) | 丙烯(CH3CH=CH2) | 一氟甲烷(CH3F) |
相对分子质量 | 32 | 42 | 34 |
沸点/℃ | 64.7 | -47.7 | -78.2 |
若只考虑相对分子质量,甲醇沸点应低于-78.2℃,甲醇沸点高的原因是________。
丙烯中含有的α键与π键个数之比为______________。
(6)铝单质为面心立方晶体,其晶胞结构如图,晶胞参数qcm,铝的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA,该晶体的空间利用率为_______________(只要求列算式,不必计算出数值)。

【题目】在一定温度下,10mL 0.40mol/L H2O2溶液发生催化分解,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A. 0~6 min的平均反应速率:v(H2O2)≈ 3.3×10﹣2 mol/(Lmin)
B. 6~10 min的平均反应速率:v(H2O2)< 3.3×10﹣2 mol/(Lmin)
C. 反应到6 min时,H2O2分解了50%
D. 反应到6 min时,c(H2O2)=0.30 mol/L