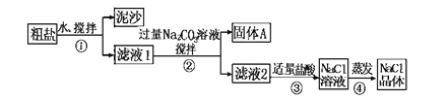
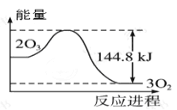
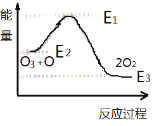
题目内容
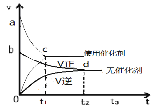
【题目】已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子)。下列说法正确的是( )

A. a线代表的是PbCO3
B. T℃时,向10 mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+)∶c(Pb2+)=3×10-5
C. d点可以代表CaCO3的饱和溶液,且c(Ca2+)= c(CO32-)
D. T℃时,向CaCO3悬浊液中加入NH4Cl固体,会使图象中d点向f点转化
【答案】C
【解析】A、离子浓度越大,则-lgc(离子)越小,所以a对应的是CaSO4,b是CaCO3,c是PbCO3,故A错误;B、CaCO3、PbCO3的饱和溶液中,c(Ca2+):c(Pb2+)=![]() =3.3×104,故B错误;C、根据Ksp(CaCO3)=2.8×10-9,d点c(Ca2+)= c(CO32-),可以代表CaCO3的饱和溶液,故C正确;D、T℃时,向CaCO3悬浊液中加入NH4Cl固体,氯化铵水解显示酸性,会消耗碳酸根离子,使得溶解平衡正向移动,所以c(Ca2+)增加,d点向着e点转化,故D错误;故选C。
=3.3×104,故B错误;C、根据Ksp(CaCO3)=2.8×10-9,d点c(Ca2+)= c(CO32-),可以代表CaCO3的饱和溶液,故C正确;D、T℃时,向CaCO3悬浊液中加入NH4Cl固体,氯化铵水解显示酸性,会消耗碳酸根离子,使得溶解平衡正向移动,所以c(Ca2+)增加,d点向着e点转化,故D错误;故选C。

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案
相关题目