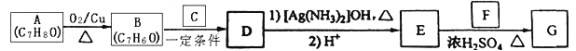题目内容
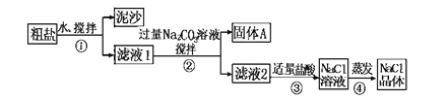
【题目】欲用含有少量氯化钙的氯化钠固体,配制溶质的质量分数为a%的氯化钠溶液,设计了下面的操作方案。根据方案操作步骤回答下列问题:

(1)称量粗盐样品m g,在托盘天平左盘上放________,右盘上放________。
(2)过滤时,漏斗下端管口应________,漏斗里液面应____________。
(3)蒸发操作时应将液体放在________中加热,等加热至________时即停止加热。
(4)在样品的溶液中加入过量的Na2CO3溶液,反应的化学方程式为_______________________。
(5)在滤液中加入盐酸的作用是__________________,反应的化学方程式为________________。
【答案】(除标明外,每空1分) (1)粗盐(放在称量纸上) 砝码(放在称量纸上)
(2)靠在烧杯内壁上 低于滤纸的边缘
(3)蒸发皿 剩余较少液体
(4)CaCl2+Na2CO3===CaCO3↓+2NaCl(2分)
(5)除去过量的Na2CO3 Na2CO3+2HCl===2NaCl+H2O+CO2↑(2分)
【解析】(1)称量时左物右码。
(2)过滤时“一贴”“二低”“三靠”。
(3)蒸发在蒸发皿中进行,当加热到剩有少量液体时停止加热,用余热蒸干。
(4)Na2CO3与CaCl2反应生成CaCO3沉淀。
(5)盐酸也是除杂试剂,用于除去所加的过量碳酸钠。

【题目】以炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氧化锌和金属锌。
Ⅰ.制取氧化锌主要工艺如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为l.0mol/L计算)。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Zn2+ | 5.2 | 6.4 |
Fe2+ | 5.8 | 8.8 |
(1)为了加快反应,“酸溶”需要适当加热,但温度不宜太高,原因是_________。
(2)加入H2O2溶液发生反应的离子方程式_______。
(3)流程图中,为了降低溶液的酸度,调节pH范围为_______;若试剂X为Zn2(OH)2CO3,加入X除杂质的离子方程式为________。
(4)已知,室温下,Ksp[Fe(OH)3]=4.0×10-38,当pH=3时,溶液中c(Fe3+)为______。从ZnCl2溶液中提取无水ZnCl2的方法是__________.
Ⅱ.制取金属锌采用碱溶解ZnO(s)+2NaOH (aq)+H2O=Na2[Zn(OH)4](aq),然后电解浸取液。
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是______。
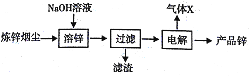
(6)以石墨作电极电解时,阳极产生的气体为______;阴极的电极反应为______。