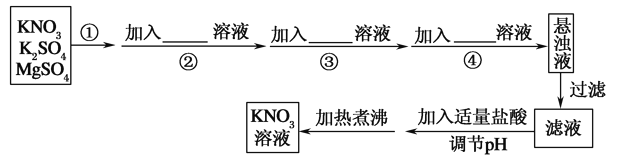
题目内容
【题目】如图所示,电流表G的指针发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液。则A、B、C分别可能为
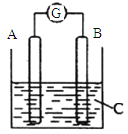
A.A是Zn,B是Cu,C是稀硫酸
B.A是Cu,B是Zn,C是稀硫酸
C.A是Fe,B是Ag,C是AgNO3稀溶液
D.A是Ag,B是Fe,C是AgNO3稀溶液
【答案】D
【解析】
试题分析:由题意电流表G的指针发生偏转,说明形成了电流,该装置为原电池装置,同时A极质量增加,B极质量减少,说明B电极为负极,A电极为正极;在原电池中通常负极的活动性比正极的活动性强,且负极能与电解质溶液发生自发的氧化还原反应,据此回答:A.该原电池装置中A极质量减少,B极质量不变,A项错误;B.该原电池装置中A极质量不变,B极质量减少,B项错误;C.该原电池装置中A极质量减少,B极质量增加,C项错误;D.该原电池中,A极(正极):2Ag++2e—= 2Ag,A极质量增加;B极(负极):Fe—2e—= Fe2+;B极质量减少,D项正确;答案选D。

练习册系列答案
相关题目