题目内容
【题目】按要求填空
Ⅰ乳酸的工业生产可以采用生物发酵法,也可以采用有机合成法,其中的一种方法是丙酸法

(1)葡萄糖的结构简式为__________,检验淀粉是否完全水解,可以选用的一种试剂是__________(填序号)。
a.溴水 b.银氨溶液 c.碘酒 d.碘化钾淀粉溶液
(2)丙酸合成法

①反应I的反应类型是___________,进行反应Ⅱ时,需要加入过量乙醇,这样做的目的是________。
②乳酸分子中有一个手性碳原子,通过两种反应可以使A中的手性碳原子失去手性。写出反应的化学方程式_____________________
Ⅱ“皂化值”是使1g 油脂皂化所需要的KOH的毫克数。某单甘油酯的皂化值数为190,通过计算可判断该油脂的名称为____________。
【答案】  C 取代 提高乳酸的转化率 CH3CH(OH)COOH
C 取代 提高乳酸的转化率 CH3CH(OH)COOH![]() CH2=CHCOOH+H2O、2CH3CH(OH)COOH+O2
CH2=CHCOOH+H2O、2CH3CH(OH)COOH+O2![]() 2H3COCOOH+2H2O 油酸甘油酯
2H3COCOOH+2H2O 油酸甘油酯
【解析】Ⅰ、(1)葡萄糖的结构简式为CH2OH—CHOH—CHOH—CHOH—CHOH—CHO,淀粉若完全水解,溶液中没有淀粉剩余,加入碘酒,溶液不变蓝,故选c,故答案为: CH2OH—CHOH—CHOH—CHOH—CHOH—CHO;c;
(2)①根据流程图,反应I为丙酸烃基上的取代反应;乳酸溶于乙醇,使平衡向生成乳酸的方向移动,可以提高乳酸的转化率,故答案为:取代反应;提高乳酸的转化率;
②乳酸分子中有一个手性碳原子(![]() ),通过消去反应或氧化反应可以使乳酸中的手性碳原子失去手性,反应的化学方程式分别为CH3CH(OH)COOH
),通过消去反应或氧化反应可以使乳酸中的手性碳原子失去手性,反应的化学方程式分别为CH3CH(OH)COOH![]() CH2=CHCOOH+H2O、2CH3CH(OH)COOH+O2
CH2=CHCOOH+H2O、2CH3CH(OH)COOH+O2![]() 2H3COCOOH+2H2O,故答案为:CH3CH(OH)COOH
2H3COCOOH+2H2O,故答案为:CH3CH(OH)COOH![]() CH2=CHCOOH+H2O、2CH3CH(OH)COOH+O2
CH2=CHCOOH+H2O、2CH3CH(OH)COOH+O2![]() 2H3COCOOH+2H2O;
2H3COCOOH+2H2O;
Ⅱ、设此单甘油酯的结构简式为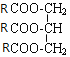 ,水解时,1mol酯耗3mol KOH
,水解时,1mol酯耗3mol KOH
即: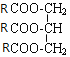 ~ 3 KOH
~ 3 KOH
(3r+173)g 3×56000mg
1g 190mg
![]() =
=![]() ,解得:r=237,因此R为-C17H33,因此该单甘油酯为油酸甘油酯,故答案为: 油酸甘油酯。
,解得:r=237,因此R为-C17H33,因此该单甘油酯为油酸甘油酯,故答案为: 油酸甘油酯。