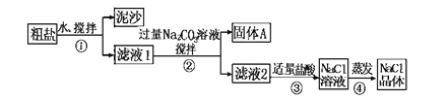
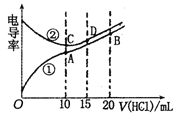
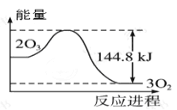
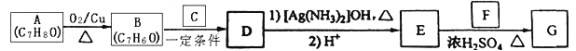题目内容
【题目】《石雅》云:“青金石色相如天,或复金屑散乱,光辉灿烂,若众星丽于天也。”天为上,所以中国古代通常称青金石为帝王石,明淸尤重。青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素。
(1)铝元素基态原子的外围电子轨道表示式为_____________,基态硅原子核外电子占有的原子轨道数为_____________个,氧、硫、氯的第一电离能由大到小顺序为________________。
(2)SCl2分子中的中心原子杂化轨道类型是_____________,该分子空间构型为__________。
(3)第四周期中,与氯原子未成对电子数相同的金属元素有_______种。
(4)晶体硅的结构与金刚石非常相似。金刚石、晶体硅和金刚砂(碳化硅)的熔点由高到低的顺序为____________(填化学式)。
(5)下表是一组物质的沸点数据:
有机物 | 甲醇(CH3OH) | 丙烯(CH3CH=CH2) | 一氟甲烷(CH3F) |
相对分子质量 | 32 | 42 | 34 |
沸点/℃ | 64.7 | -47.7 | -78.2 |
若只考虑相对分子质量,甲醇沸点应低于-78.2℃,甲醇沸点高的原因是________。
丙烯中含有的α键与π键个数之比为______________。
(6)铝单质为面心立方晶体,其晶胞结构如图,晶胞参数qcm,铝的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA,该晶体的空间利用率为_______________(只要求列算式,不必计算出数值)。

【答案】 ![]() 8 O> Cl > S sp3 V形 4 C>SiC>Si 甲醇分子间存在氢键 8∶1
8 O> Cl > S sp3 V形 4 C>SiC>Si 甲醇分子间存在氢键 8∶1 ![]()
【解析】(1)铝元素的质子数是13,基态原子的外围电子轨道表示式为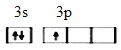 。基态硅原子核外电子排布式为1s22s22p63s23p2,占有的原子轨道数为8个。非金属性越强,第一电离能越大,则氧、硫、氯的第一电离能由大到小顺序为O> Cl > S。(2)SCl2分子中的中心原子S原子的价层电子对数=
。基态硅原子核外电子排布式为1s22s22p63s23p2,占有的原子轨道数为8个。非金属性越强,第一电离能越大,则氧、硫、氯的第一电离能由大到小顺序为O> Cl > S。(2)SCl2分子中的中心原子S原子的价层电子对数=![]() ,所以杂化轨道类型是sp3,该分子空间构型为V形。(3)氯原子未成对电子数是1个,则第四周期中,与氯原子未成对电子数相同的金属元素有K、Sc、Cu、Ga,共计4种。(4)金刚石、晶体硅和金刚砂(碳化硅)均是原子晶体,原子半径是C<Si,则熔点由高到低的顺序为C>SiC>Si。(5)由于甲醇分子间存在氢键,从而导致甲醇沸点高。单键都是α键,双键中含有1个α键和1个π键,因此丙烯中含有的α键与π键个数之比为8∶1。(6)铝单质为面心立方晶体,晶胞中铝原子的个数是8×1/8+6×1/2=4。晶胞参数qcm,铝的原子半径为r pm,则该晶体的空间利用率为
,所以杂化轨道类型是sp3,该分子空间构型为V形。(3)氯原子未成对电子数是1个,则第四周期中,与氯原子未成对电子数相同的金属元素有K、Sc、Cu、Ga,共计4种。(4)金刚石、晶体硅和金刚砂(碳化硅)均是原子晶体,原子半径是C<Si,则熔点由高到低的顺序为C>SiC>Si。(5)由于甲醇分子间存在氢键,从而导致甲醇沸点高。单键都是α键,双键中含有1个α键和1个π键,因此丙烯中含有的α键与π键个数之比为8∶1。(6)铝单质为面心立方晶体,晶胞中铝原子的个数是8×1/8+6×1/2=4。晶胞参数qcm,铝的原子半径为r pm,则该晶体的空间利用率为![]() 。
。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案