��Ŀ����
����Ŀ��PbI2������ɫ��ĩ����������������̫���ܵ�ص������������װ�Ǧ���ԭ�ϡ��ϳ�PbI2��ʵ��������ͼ1��
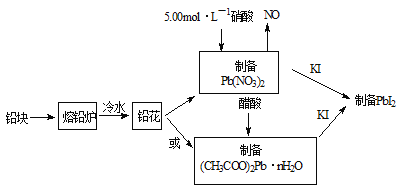

��1����Ǧ���Ƴ�Ǧ����Ŀ����_____________��
��2��31.05gǦ����5.00mol��L��1�������ܽ⣬����������5.00 mol��L��1����_______mL��
��3��ȡһ������(CH3COO)2Pb��nH2O��Ʒ��N2�����м��ȣ������Ʒ��������ʣ���![]() �����¶ȵı仯��ͼ2��ʾ����֪����Ʒ��75��ʱ����ȫʧȥ�ᾧˮ����
�����¶ȵı仯��ͼ2��ʾ����֪����Ʒ��75��ʱ����ȫʧȥ�ᾧˮ����
��(CH3COO)2Pb��nH2O�нᾧˮ��Ŀn=__________������������
��100��200���ֽ����ΪǦ���������һ���л������л���Ϊ___________��д����ʽ����
��4����ȡһ��������PbI2���壬������ˮ���Ƴ�����ʱ�ı�����Һ��ȷ��ȡ25.00mL PbI2������Һ�ִμ��������ӽ�����֬RH�У�������2RH(s) + Pb2+(aq) = R2Pb(s) +2H+(aq)������ƿ��������Һ�����������ˮ��ϴ��֬������Һ�����ԣ���ϴ��Һ�ϲ�����ƿ�С�����2��3�η�̪��Һ����0.002500mol��L��1NaOH��Һ�ζ������ζ��յ�ʱ��ȥ�������Ʊ���Һ20.00mL��������ʱPbI2��KspΪ___________��
��5��̽��Ũ�ȶԻǻ�Ǧ�����ܽ�ƽ���Ӱ�졣
�û�ѧС��������ṩ�Լ��������ʵ�飬��˵��Ũ�ȶԳ����ܽ�ƽ���Ӱ�졣
�ṩ�Լ���NaI������Һ��NaCl������Һ��FeCl3������Һ��PbI2������Һ��PbI2����Һ��
��Ϣ��ʾ��Pb2+��Cl�����γɽ��ȶ���PbCl42�������ӡ�
����д�±��Ŀհ״���
ʵ������ | ʵ�鷽�� | ʵ������ԭ����� |
�ٻ�����Ũ�������ƽ���Ӱ�� | ȡPbI2������Һ������һ֧�Թ��У��ٵ��뼸��NaI������Һ | ������Һ��c(I��)����ʹQ������PbI2��Ksp |
��Ǧ����Ũ�ȼ�С��ƽ���Ӱ�� | ________ | ����________ ԭ��________ |
��________ | ��PbI2����Һ�е��뼸��FeCl3������Һ | ����ɫ������ʧ ________ |
���𰸡���������ĽӴ�������ӿ��ܽⷴӦ���� 80 3 C4H6O3 4��10��9 ȡPbI2����Һ������һ֧�Թ��У��ټ�������NaCl������Һ ��ɫ������ʧ ԭ�����γ�PbCl42-��������Һ��c��Pb2+����С��ʹQcС����pbI2��Ksp Ǧ���Ӻ͵�����Ũ�ȶ���С��ƽ���Ӱ�� PbI2+2Fe3++4Cl-=PbCl42-+2Fe2++I2
��������
��1����Ǧ���Ƴ�Ǧ������Ϊ���������ᷴӦ�ĽӴ�������ӿ��ܽⷴӦ���ʣ�
��2��31.05gǦ�����ʵ���Ϊ31.05g��207g/mol��0.15mol�����ݷ�Ӧ����ʽ��֪���ĵ�HNO3�����ʵ���Ϊ0.15mol��8/3=0.4mol�����ɵ�NO�����ʵ���Ϊ0.15mol��2/3=0.1mol����������Һ�����Ϊ0.4mol��5.00molL��1=0.08L=80.0mL��
��3���ټ�����Ʒ����ʼ����Ϊ100�ˣ����ݹ�������ʵĹ�ʽ��֪��75��ʱʣ�����Ϊ87.75�ˣ����ɵ�ˮ����Ϊ100g��87.75g=12.25g�������Ǧ��ˮ�����ʵ���֮��Ϊ![]() =1��3����n=3��
=1��3����n=3��
��Ǧ������������Ϊ58.84�ˣ�����Ǧ�����ʵ���Ϊ=![]() ������Ǧԭ���غ㣬Ǧ�������PbOx�������ʵ���Ϊ
������Ǧԭ���غ㣬Ǧ�������PbOx�������ʵ���Ϊ![]() �����������Ħ������Ϊ58.84g��
�����������Ħ������Ϊ58.84g��![]() =223g/mol��ΪPbO���л��������Ϊ85.75g��58.84g=26.91g�����л��������Ӧ�����ĸ�̼ԭ�ӣ����ʵ���Ϊ
=223g/mol��ΪPbO���л��������Ϊ85.75g��58.84g=26.91g�����л��������Ӧ�����ĸ�̼ԭ�ӣ����ʵ���Ϊ![]() mol��Ħ������Ϊ26.91g��
mol��Ħ������Ϊ26.91g��![]() =102������ԭ���غ��֪�л���ķ���ʽΪC4H6O3��
=102������ԭ���غ��֪�л���ķ���ʽΪC4H6O3��
��4��n��H+�� = n��NaOH�� =" 0.002500" molL��1 �� 20.00mL �� 10��3LmL��1 =" 5.000" �� 10��5mol �� n[Pb2+��aq��] =" 1/2" n��H+�� =" 2.500" �� 10��5 mol �� c��Pb2+�� =![]() =" 1.000" �� 10��3 molL��1 ��Ksp��PbI2�� = c��Pb2+��c2��I���� = 4c3��Pb2+�� =" 4" �� ��1.000��10��3��3=4.000��10��9��
=" 1.000" �� 10��3 molL��1 ��Ksp��PbI2�� = c��Pb2+��c2��I���� = 4c3��Pb2+�� =" 4" �� ��1.000��10��3��3=4.000��10��9��
��5��Ӱ�컯ѧƽ���ƶ���������Ũ�ȣ�����Ӧ���С�����Ũ�ȣ�����������У������������С��Ӧ�Ũ��ƽ��������У����ݵ⻯Ǧ���ܽ�ƽ�⣺PbI2��S��![]() Pb2+��aq��+2I-��aq������Һ��c��I-������ƽ��������У�Pb2+��Cl-���γɽ��ȶ���PbCl42-�����ӣ���������NaCl������Һ���ᵼ����Һ��c��Pb2+����С��ƽ�����ҽ��У�����Ǧ���Ӻ����������ӿ��Է���������ԭ��Ӧ����������FeCl3������Һ�������ĵ⻯Ǧ�������ƶ���
Pb2+��aq��+2I-��aq������Һ��c��I-������ƽ��������У�Pb2+��Cl-���γɽ��ȶ���PbCl42-�����ӣ���������NaCl������Һ���ᵼ����Һ��c��Pb2+����С��ƽ�����ҽ��У�����Ǧ���Ӻ����������ӿ��Է���������ԭ��Ӧ����������FeCl3������Һ�������ĵ⻯Ǧ�������ƶ���

 ��������ϵ�д�
��������ϵ�д�