题目内容
【题目】将质量为W1g的钠、铝混合物投入一定量的水中充分反应,金属没有剩余,溶液澄清,共收集到标准状况下的气体V1L。向溶液中逐滴加入浓度为amol/L的盐酸,过程中有白色沉淀生成后又逐渐溶解,当沉淀恰好消失时所加盐酸体积为V2L,将溶液在HCl气氛中小心蒸干得固体W2g。下列所列关系式中正确的是
A. 35.5a=(W2-W1)V2B. n(Al)>![]() mol
mol
C. n(Na)+3n(Al)=![]() molD. aV2=
molD. aV2=![]()
【答案】C
【解析】
钠、铝共融物投入一定量的水中可发生:2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,加入盐酸体积为V2L时,溶液的溶质为NaCl和AlCl3。
A、W2-W1为氯离子的质量,则W2-W1=a×V2×35.5,故A错误;
B、金属没有剩余,根据方程式可知,n(Na)≥n(Al),而23n(Na)+27n(Al)=W1,联立解得n(Al)≤![]() mol,故B错误;
mol,故B错误;
C、由2Na+2H2O=2NaOH+H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,![]() n(Na)+
n(Na)+![]() n(Al)=
n(Al)=![]() ,故n(Na)+3n(Al)=
,故n(Na)+3n(Al)=![]() mol,故C正确;
mol,故C正确;
D、aV2可以表示氯离子物质的量,根据电荷守恒可知:氯离子物质的量等于金属提供电子物质的量,故aV2=![]() ×2=
×2=![]() ,故D错误;
,故D错误;
故选C。

【题目】PbI2(亮黄色粉末)是生产新型敏化太阳能电池的敏化剂——甲胺铅碘的原料。合成PbI2的实验流程如图1:
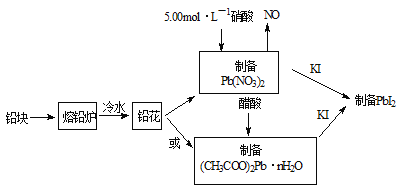

(1)将铅块制成铅花的目的是_____________。
(2)31.05g铅花用5.00mol·L-1的硝酸溶解,至少需消耗5.00 mol·L-1硝酸_______mL。
(3)取一定质量(CH3COO)2Pb·nH2O样品在N2气氛中加热,测得样品固体残留率)(![]() )随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水)。
)随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水)。
①(CH3COO)2Pb·nH2O中结晶水数目n=__________(填整数)。
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为___________(写分子式)。
(4)称取一定质量的PbI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s) + Pb2+(aq) = R2Pb(s) +2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中。加入2~3滴酚酞溶液,用0.002500mol·L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00mL。则室温时PbI2的Ksp为___________。
(5)探究浓度对磺化铅沉淀溶解平衡的影响。
该化学小组根据所提供试剂设计两个实验,来说明浓度对沉淀溶解平衡的影响。
提供试剂:NaI饱和溶液、NaCl饱和溶液、FeCl3饱和溶液、PbI2饱和溶液、PbI2悬浊液。
信息提示:Pb2+和Cl-能形成较稳定的PbCl42-络离子。
请填写下表的空白处:
实验内容 | 实验方法 | 实验现象及原因分析 |
①磺离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再滴入几滴NaI饱和溶液 | 现象:溶液中c(I-)增大,使Q大于了PbI2的Ksp |
②铅离子浓度减小对平衡的影响 | ________ | 现象:________ 原因:________ |
③________ | 在PbI2悬浊液中滴入几滴FeCl3饱和溶液 | 现象:黄色浑浊消失 ________ |