题目内容
【题目】CuSO4溶液是中学化学及工农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,向盛有一定量硫酸铜晶体的烧杯中加入适量的蒸馏水,并不断搅拌,结果得到悬浊液。他认为是固体没有完全溶解,于是对悬浊液加热,结果发现浑浊更明显了。原因是(用离子方程式和简要文字说明表示)___________________________,最后,他向烧杯中加入了一定量的_________________溶液,得到了澄清的CuSO4溶液。
(2)该同学利用制得的CuSO4溶液,进行了以下实验探究。
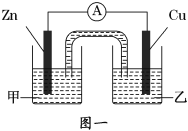
①图一是根据反应Zn+CuSO4═Cu+ZnSO4设计成的锌铜原电池。电解质溶液乙是______溶液,Cu极的电极反应式是____________________。
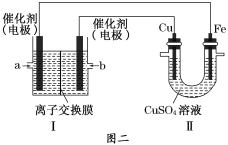
②图二中,Ⅰ是甲烷燃料电池(电解质溶液为NaOH溶液)的结构示意图,该同学想在Ⅱ中实现铁上镀铜,则Fe电极为__________(填“阳极”或“阴极”)。若铜电极的质量减轻3.2 g,则消耗的CH4在标准状况下的体积为___________L。
【答案】Cu2++2H2O![]() Cu(OH)2+2H+,升高温度水解程度增大,产生更多难溶性的Cu(OH)2 H2SO4 CuSO4 Cu2++2e-=Cu 阴极 0.28L
Cu(OH)2+2H+,升高温度水解程度增大,产生更多难溶性的Cu(OH)2 H2SO4 CuSO4 Cu2++2e-=Cu 阴极 0.28L
【解析】
(1)硫酸铜是强酸弱碱盐,在硫酸铜溶液中,铜离子水解产生Cu(OH)2和硫酸,使得溶液显酸性;
(2)①负极为Zn,电解质溶液中含锌离子;Cu为正极,铜离子得到电子发生还原反应;
②铁上镀铜,则Cu为阳极,Fe为阴极,Cu电极与b相连,b为原电池的正极,a为负极,据此解答。
(1) 硫酸铜是强酸弱碱盐,在硫酸铜溶液中,Cu2+发生水解反应,消耗水电离产生的OH-,促进了水的电离,水解的离子方程式为:Cu2++2H2O![]() Cu(OH)2+2H+,水解生成氢氧化铜在水中溶解度小,使得溶液变浑浊,由于水解反应是吸热反应,所以升高温度,水解平衡右移,因此看到浑浊更明显了;由于水解使溶液显酸性,根据平衡移动原理,同时不能引入杂质,则可以加入少量硫酸来抑制盐的水解;
Cu(OH)2+2H+,水解生成氢氧化铜在水中溶解度小,使得溶液变浑浊,由于水解反应是吸热反应,所以升高温度,水解平衡右移,因此看到浑浊更明显了;由于水解使溶液显酸性,根据平衡移动原理,同时不能引入杂质,则可以加入少量硫酸来抑制盐的水解;
(2)①根据反应Zn+CuSO4═Cu+ZnSO4可知:Zn在反应中失去电子,被氧化,所以Zn为负极,电解质溶液中的Cu2+得电子生成铜,Cu为正极,Cu2+在正极上得到电子发生还原反应;电极反应式为Cu2++2e-=Cu,所以电解质溶液乙为CuSO4溶液;
②铁上镀铜,则Fe为阴极,Fe电极上发生的反应为:Cu2++2e-=Cu;与Fe电极连接的a为负极,a处通入CH4气体,CH4失去电子,发生氧化反应,由于电解质溶液为碱性,所以负极的电极反应式为:CH4-8e-+10OH-=CO32-+7H2O;Cu为阳极,Cu电极上发生的反应为:Cu-2e-=Cu2+,Cu电极与b相连,b为原电池的正极,即b处通入O2,若铜电极的质量减轻3.2 g,n(Cu)=3.2g÷64g/mol=0.05mol,n(e-)=0.05mol×2=0.10mol,在整个闭合回路中电子转移数目相等,根据负极电极反应式CH4-8e-+10OH-=CO32-+7H2O可知:1molCH4反应失去8mol电子,则反应转移0.1mol电子,消耗甲烷的物质的量为n(CH4)=0.1mol÷8=0.0125mol,则消耗的CH4在标准状况下的体积为V=0.0125mol×22.4L/mol=0.28L。

 名校课堂系列答案
名校课堂系列答案【题目】PbI2(亮黄色粉末)是生产新型敏化太阳能电池的敏化剂——甲胺铅碘的原料。合成PbI2的实验流程如图1:
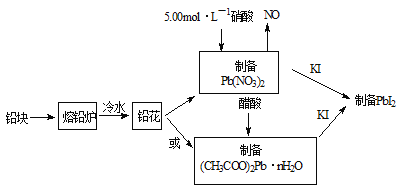

(1)将铅块制成铅花的目的是_____________。
(2)31.05g铅花用5.00mol·L-1的硝酸溶解,至少需消耗5.00 mol·L-1硝酸_______mL。
(3)取一定质量(CH3COO)2Pb·nH2O样品在N2气氛中加热,测得样品固体残留率)(![]() )随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水)。
)随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水)。
①(CH3COO)2Pb·nH2O中结晶水数目n=__________(填整数)。
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为___________(写分子式)。
(4)称取一定质量的PbI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s) + Pb2+(aq) = R2Pb(s) +2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中。加入2~3滴酚酞溶液,用0.002500mol·L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00mL。则室温时PbI2的Ksp为___________。
(5)探究浓度对磺化铅沉淀溶解平衡的影响。
该化学小组根据所提供试剂设计两个实验,来说明浓度对沉淀溶解平衡的影响。
提供试剂:NaI饱和溶液、NaCl饱和溶液、FeCl3饱和溶液、PbI2饱和溶液、PbI2悬浊液。
信息提示:Pb2+和Cl-能形成较稳定的PbCl42-络离子。
请填写下表的空白处:
实验内容 | 实验方法 | 实验现象及原因分析 |
①磺离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再滴入几滴NaI饱和溶液 | 现象:溶液中c(I-)增大,使Q大于了PbI2的Ksp |
②铅离子浓度减小对平衡的影响 | ________ | 现象:________ 原因:________ |
③________ | 在PbI2悬浊液中滴入几滴FeCl3饱和溶液 | 现象:黄色浑浊消失 ________ |