题目内容
【题目】(1)下列物质中:①SO2 ②液态氯化氢 ③CH4 ④熔融NaOH ⑤NH4Cl固体 ⑥氨水。能导电的是__________(填序号,下同)。属于电解质的是__________。属于非电解质的是__________。
(2)1.204×1024个H2SO4分子的物质的量为__________mol,共含__________个氢原子。将上述H2SO4溶于水配成600 mL溶液,再加水稀释到1000 mL,稀释后溶液的物质的量浓度为__________mol/L。
(3)K2SO4和Fe2(SO4)3的混合溶液,已知其中Fe3+的浓度为0.5mol/L,SO42-浓度为0.9mol/L,则K+的物质的量浓度为__________mol/L。
(4)有以下四种物质:① 标准状况下11.2 L CO2 ② 5 g H2 ③ 1.204×1024个N2分子 ④ 18 g H2O,其中质量最大的是____(填序号),在常温常压下体积最大的是___(填序号)。
(5)标准状况下11.2 L由CH4、N2组成的混和气体的质量为10 g,该混合气体中CH4与N2的分子数之比为_________。
(6)将标准状况下336 L HCl气体完全溶于1 L水中,所得溶液的密度为 ρ g/cm3,则该溶液的物质的量浓度为_____ mol/L(计算结果中的数字保留整数)
【答案】④⑥ ②④⑤ ①③ 2 2.408×1024(4NA) 2 0.3mol/L ③ ② 2:1 10ρ
【解析】
(1)、能导电的物质有金属,石墨,酸、碱、盐的水溶液,离子构成的物质的熔融态(如熔融态的盐、碱、金属氧化物),故能导电的是④⑥;电解质是在水溶液中或熔融状态下能导电的化合物,所有的酸碱盐都属于电解质,故上述属于电解质的是②④⑤;非电解质是在水溶液中和熔融状态下都不能导电的化合物,大多数有机物如酒精,蔗糖,苯,四氯化碳及无机物CO2、SO2、SO3、NH3都属于非电解质,故上述属于非电解质的是①③;
故答案为:④⑥;②④⑤;①③;
(2)、1.204×1024个H2SO4分子的物质的量为:![]() ,共含氢原子4NA个。溶液稀释前后溶质的物质的量不变,故稀释后溶液的物质的量浓度为:
,共含氢原子4NA个。溶液稀释前后溶质的物质的量不变,故稀释后溶液的物质的量浓度为:![]() ,
,
故答案为:2 ;2.408×1024(4NA);2;
(3)、根据正负电荷守恒,K+的物质的量浓度为:![]() ,
,
故答案为:![]() ;
;
(4)、①标准状况下11.2 L CO2物质的量为0.5 mol,质量为0.5 mol×44 g/mol= 22g;
②5 g H2物质的量为![]() ;
;
③1.204×1024个N2分子物质的量为:![]() ,质量为
,质量为![]() ;
;
④18 g H2O的物质的量为![]() ;
;
因此,质量最大的为③;而相同条件下气体体积与物质的量成正比,故物质的量越大,体积越大,因此常温常压下体积最大的是②;
(5)、标准状况下11.2 L由CH4、N2组成的混和气体的质量为10g,则混合气体物质的量为0.5 mol,设混合气体中CH4物质的量为x mol, 则有![]() ,
,
解得:x=![]() ,即CH4物质的量为
,即CH4物质的量为![]() ,则N2物质的量为
,则N2物质的量为![]() ,相同条件下,气体的分子数之比等于物质的量之比,故混合气体中CH4与N2的分子数之比为:2:1;
,相同条件下,气体的分子数之比等于物质的量之比,故混合气体中CH4与N2的分子数之比为:2:1;
(6)、将标准状况下336 L HCl气体完全溶于1 L水中,所得溶液的密度为ρg/cm3,则可得溶质HCl物质的量为![]() ,其质量为:15 mol×36.5 g/mol= 547.5g,而1 L水的质量为:1 L×1000 g/L= 1000 g,因此,溶液的总质量为547.5g+ 1000g= 1547.5g,溶液的体积为
,其质量为:15 mol×36.5 g/mol= 547.5g,而1 L水的质量为:1 L×1000 g/L= 1000 g,因此,溶液的总质量为547.5g+ 1000g= 1547.5g,溶液的体积为![]() ,故该溶液物质的量浓度为:
,故该溶液物质的量浓度为: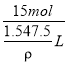 =10
=10![]() 。
。

【题目】(一)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于____晶体,SeO2中Se原子采取的杂化类型为___。
(二)A、X、Y、Z、W、M、G等原子序数一次增大的前四周期元素
元素 | 相关信息 |
A | 原子核外电子总数与其周期数相同 |
X | 其羞态原子的L层中有3个未成对电子 |
Y | 荃态原子的2p轨道上有一个电子的自旋方向与2p轨道上其它电子的自旋方向相反 |
Z | 原子核外p电子数比s电子数多l个 |
W | 原子的第一至第四电离能(kJ·mol-1)分别是:I1=578,I2=1817 I3=2745 I4=11575 |
M | 元素的主族数与周期数相差4 |
G | 其基态原子最外层电子数为1,其余各电子层均充满电子 |
(1)画出W基态原子的核外电子排布图______。
(2)A2Y的VSEPR模型名称为____。
(3)已知为X2Y分子中Y原子只与一个X原子相连,请根据等电子原理,写出X2Y的电子式____。
(4)X、G形成的某种化合物的晶胞结构如图所示,则其化学式为______。
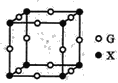
(5)已知Z和M形成的化合物的晶体密度为pg·cm-3,阿伏加德罗常效为NA,该晶体中两个距离最近的Z离子中心间距离为_____cm。
【题目】PbI2(亮黄色粉末)是生产新型敏化太阳能电池的敏化剂——甲胺铅碘的原料。合成PbI2的实验流程如图1:
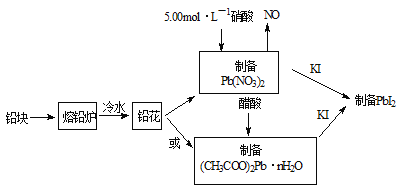

(1)将铅块制成铅花的目的是_____________。
(2)31.05g铅花用5.00mol·L-1的硝酸溶解,至少需消耗5.00 mol·L-1硝酸_______mL。
(3)取一定质量(CH3COO)2Pb·nH2O样品在N2气氛中加热,测得样品固体残留率)(![]() )随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水)。
)随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水)。
①(CH3COO)2Pb·nH2O中结晶水数目n=__________(填整数)。
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为___________(写分子式)。
(4)称取一定质量的PbI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s) + Pb2+(aq) = R2Pb(s) +2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中。加入2~3滴酚酞溶液,用0.002500mol·L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00mL。则室温时PbI2的Ksp为___________。
(5)探究浓度对磺化铅沉淀溶解平衡的影响。
该化学小组根据所提供试剂设计两个实验,来说明浓度对沉淀溶解平衡的影响。
提供试剂:NaI饱和溶液、NaCl饱和溶液、FeCl3饱和溶液、PbI2饱和溶液、PbI2悬浊液。
信息提示:Pb2+和Cl-能形成较稳定的PbCl42-络离子。
请填写下表的空白处:
实验内容 | 实验方法 | 实验现象及原因分析 |
①磺离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再滴入几滴NaI饱和溶液 | 现象:溶液中c(I-)增大,使Q大于了PbI2的Ksp |
②铅离子浓度减小对平衡的影响 | ________ | 现象:________ 原因:________ |
③________ | 在PbI2悬浊液中滴入几滴FeCl3饱和溶液 | 现象:黄色浑浊消失 ________ |