题目内容
【题目】下列离子方程式书写不正确的是
A.向CaCl2 溶液中通入少量CO2气体:Ca2+ + CO2 + H2O=CaCO3↓ + 2H+
B.大理石与醋酸反应:CaCO3 + 2CH3COOH= Ca2+ + 2CH3COO-+ H2O + CO2↑
C.制备Fe(OH)3胶体:Fe3+ + 3H2O![]() Fe(OH)3(胶体)+ 3H+
Fe(OH)3(胶体)+ 3H+
D.少量碳酸氢钠溶液与足量石灰水反应:Ca2+ + OH-+ HCO3-=CaCO3↓ + H2O
【答案】A
【解析】
A、向CaCl2 溶液中通入少量CO2气体:Ca2+ + CO2 + H2O=CaCO3↓ + 2H+,由弱酸制取强酸,违背客观事实,故A错误;
B、大理石与醋酸反应:CaCO3 + 2CH3COOH= Ca2+ + 2CH3COO-+ H2O + CO2↑,正确;
C.、制备Fe(OH)3胶体:Fe3+ + 3H2O![]() Fe(OH)3(胶体)+ 3H+,正确;
Fe(OH)3(胶体)+ 3H+,正确;
D.、少量碳酸氢钠溶液与足量石灰水反应:Ca2+ + OH-+ HCO3-=CaCO3↓ + H2O,正确;
故选A。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】(一)镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料。已知:SeO2在常温下是白色的晶体,熔点为340-350℃,则SeO2晶体属于____晶体,SeO2中Se原子采取的杂化类型为___。
(二)A、X、Y、Z、W、M、G等原子序数一次增大的前四周期元素
元素 | 相关信息 |
A | 原子核外电子总数与其周期数相同 |
X | 其羞态原子的L层中有3个未成对电子 |
Y | 荃态原子的2p轨道上有一个电子的自旋方向与2p轨道上其它电子的自旋方向相反 |
Z | 原子核外p电子数比s电子数多l个 |
W | 原子的第一至第四电离能(kJ·mol-1)分别是:I1=578,I2=1817 I3=2745 I4=11575 |
M | 元素的主族数与周期数相差4 |
G | 其基态原子最外层电子数为1,其余各电子层均充满电子 |
(1)画出W基态原子的核外电子排布图______。
(2)A2Y的VSEPR模型名称为____。
(3)已知为X2Y分子中Y原子只与一个X原子相连,请根据等电子原理,写出X2Y的电子式____。
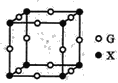
(4)X、G形成的某种化合物的晶胞结构如图所示,则其化学式为______。
(5)已知Z和M形成的化合物的晶体密度为pg·cm-3,阿伏加德罗常效为NA,该晶体中两个距离最近的Z离子中心间距离为_____cm。
【题目】PbI2(亮黄色粉末)是生产新型敏化太阳能电池的敏化剂——甲胺铅碘的原料。合成PbI2的实验流程如图1:
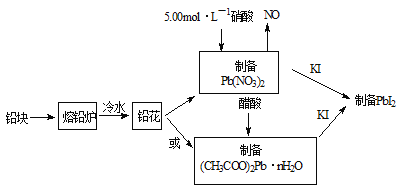

(1)将铅块制成铅花的目的是_____________。
(2)31.05g铅花用5.00mol·L-1的硝酸溶解,至少需消耗5.00 mol·L-1硝酸_______mL。
(3)取一定质量(CH3COO)2Pb·nH2O样品在N2气氛中加热,测得样品固体残留率)(![]() )随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水)。
)随温度的变化如图2所示(已知:样品在75℃时已完全失去结晶水)。
①(CH3COO)2Pb·nH2O中结晶水数目n=__________(填整数)。
②100~200℃间分解产物为铅的氧化物和一种有机物,则该有机物为___________(写分子式)。
(4)称取一定质量的PbI2固体,用蒸馏水配制成室温时的饱和溶液,准确移取25.00mL PbI2饱和溶液分次加入阳离子交换树脂RH中,发生:2RH(s) + Pb2+(aq) = R2Pb(s) +2H+(aq),用锥形瓶接收流出液,最后用蒸馏水淋洗树脂至流出液呈中性,将洗涤液合并到锥形瓶中。加入2~3滴酚酞溶液,用0.002500mol·L-1NaOH溶液滴定,到滴定终点时用去氢氧化钠标准溶液20.00mL。则室温时PbI2的Ksp为___________。
(5)探究浓度对磺化铅沉淀溶解平衡的影响。
该化学小组根据所提供试剂设计两个实验,来说明浓度对沉淀溶解平衡的影响。
提供试剂:NaI饱和溶液、NaCl饱和溶液、FeCl3饱和溶液、PbI2饱和溶液、PbI2悬浊液。
信息提示:Pb2+和Cl-能形成较稳定的PbCl42-络离子。
请填写下表的空白处:
实验内容 | 实验方法 | 实验现象及原因分析 |
①磺离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再滴入几滴NaI饱和溶液 | 现象:溶液中c(I-)增大,使Q大于了PbI2的Ksp |
②铅离子浓度减小对平衡的影响 | ________ | 现象:________ 原因:________ |
③________ | 在PbI2悬浊液中滴入几滴FeCl3饱和溶液 | 现象:黄色浑浊消失 ________ |