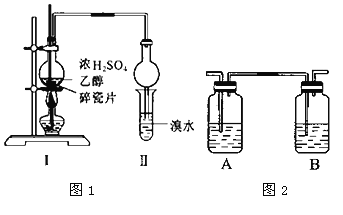
题目内容
【题目】某科学家利用二氧化饰(CeO2)在太阳能作用下将H2O、CO2转变为H2、 CO,其过程如下所示:
mCeO2![]() (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+x H2O+xCO2![]() mCeO2+xH2+xCO2
mCeO2+xH2+xCO2
下列说法不正确的是
A.该过程中CeO2是H2O、CO2转变为H2、CO反应的催化剂
B.利用CeO2作催化剂-既可使该转变过程速率提高。亦可减小能量的消 耗,并可提高反应物转化率
C.mmol CeO2参加反应,气体物质的量增加x mol
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH - - 2e = CO32- +2H2O
【答案】B
【解析】
A. 通过太阳能实现总反应H2O+CO2→H2+CO+O2可知:CeO2没有消耗,CeO2为催化剂,故A正确;
B.催化剂只能改变反应速率,影响反应历程,改变反应活化能,不影响平衡移动和转化率,故B错误;
C. 根据mCeO2![]() (m-x)CeO2·xCe+xO2,mmol CeO2参加反应,气体物质的量增加x mol O2,故C正确;
(m-x)CeO2·xCe+xO2,mmol CeO2参加反应,气体物质的量增加x mol O2,故C正确;
D. CO在负极失电子生成CO2,在碱性条件下再与OH生成CO32,故负极反应式应为:CO+4OH2e═CO32+2H2O,故D正确;
答案选B。

【题目】下图是元素周期表的一部分,A、B、C、D、E、X是周期表给出元素组成的常见单质或化合物。
① | |||||||||||||||||
④ | ⑤ | ⑥ | |||||||||||||||
② | ③ | ⑦ | |||||||||||||||
Fe | As | ||||||||||||||||
I、元素周期表是人们研究物质性质的重要工具。Y由②⑥⑦三种元素组成,它的水溶液是生活中常见的消毒剂。As可与Y的水溶液反应,产物有As的最高价含氧酸,该反应的化学方程式为_______,当消耗1mol还原剂时,转移的电子个数为_______。
Ⅱ、A、B、C、D、E、X存在如下图转化关系〔部分生成物和反应条件略去〕。

(1)假设E为氧化物,那么A与水反应的化学方程式为_______。
①当X是碱性盐溶液,C分子中有22个电子时,那么C的电子式为_______。
②表示
③当X为金属单质时,那么X与B的稀溶液反应生成C的离子反应方程式为_______。
(2)假设E为单质气体,D为白色沉淀,B含有的化学键类型为_______,C与X反应的离子方程式为_______。
(3)①和⑤形成的化合物是一种可燃性液体,其燃烧产物之一是大气中的要紧成分,1.6克该物质在氧气中完全燃烧放出热量31.2kJ,写出热化学方程式_______。
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用①和⑥组成的化合物和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式_______。
(5)元素②的单质在一定条件下,能与①的单质化合生成一种化合物,熔点为800℃。该化合物能与水反应放氢气,假设将1mol该化合物和1mol③形成的单质混合加入足量的水,充分反应后生成气体的体积是(标准状况下)_______。
【题目】下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
a | |||||||||||||||||
b | c | d | e | ||||||||||||||
f | g | ||||||||||||||||
h | |||||||||||||||||
(1)请画出上述元素h的原子结构示意图_______;元素h位于元素周期表的第_____区。
(2)e、g两种元素的气态氢化物中更稳定的是_______(写化学式);
(3)b2a2分子的电子式是________ ,该分子中存在的σ键与π键的个数比为_______。
(4)c、d两种元素中第一电离能较大的是_________(写元素符号)。
(5)f和g两种元素形成的化合物是______(填“离子化合物”“共价化合物”)。a2d分子是_________分子(填极性分子或者非极性分子)。