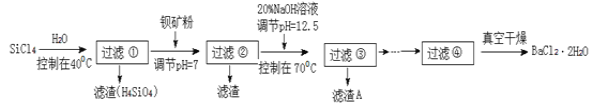
题目内容
【题目】(题文)25℃时,用0.10 mol/L的氨水滴定10.00 mL 0.05 mol/L的二元酸H2A的溶液,滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法正确的是
的关系如图所示。下列说法正确的是

A. H2A的电离方程式为H2A![]() H++HA -
H++HA -
B. B点溶液中,水电离出的氢离子浓度为1.0×10-6 mol/L
C. C点溶液中,c(NH4+)+c(NH3·H2O)= 2c(A2-)
D. 25℃时,该氨水的电离平衡常数为![]()
【答案】B
【解析】根据图像,A点时,0.05 mol/L的二元酸H2A的溶液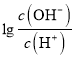 = -12,此时c(OH-)=10-12c(H+),c(OH-)=1.0×10-13 mol/L,c(H+)=0.1 mol/L,说明H2A为二元强酸。A、H2A的电离方程式为H2A=2H++A 2-,故A错误;B、B点溶液中,加入了10mL 0.10 mol/L的氨水,恰好完全反应,此时溶液应为(NH4)2A溶液,
= -12,此时c(OH-)=10-12c(H+),c(OH-)=1.0×10-13 mol/L,c(H+)=0.1 mol/L,说明H2A为二元强酸。A、H2A的电离方程式为H2A=2H++A 2-,故A错误;B、B点溶液中,加入了10mL 0.10 mol/L的氨水,恰好完全反应,此时溶液应为(NH4)2A溶液, 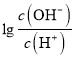 = -2,c(OH-)=10-2c(H+),c(OH-)=1.0×10-8 mol/L,c(H+)=1.0×10-6mol/L,此时溶液因NH4+水解呈酸性,溶液中的氢离子均是水电离产生的,故水电离出的氢离子浓度为1.0×10-6 mol/L,故B正确;C、C点溶液中,加入了12.5 mL 0.10 mol/L的氨水,此时溶液应为(NH4)2A和NH3·H2O混合溶液,
= -2,c(OH-)=10-2c(H+),c(OH-)=1.0×10-8 mol/L,c(H+)=1.0×10-6mol/L,此时溶液因NH4+水解呈酸性,溶液中的氢离子均是水电离产生的,故水电离出的氢离子浓度为1.0×10-6 mol/L,故B正确;C、C点溶液中,加入了12.5 mL 0.10 mol/L的氨水,此时溶液应为(NH4)2A和NH3·H2O混合溶液, 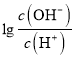 = 0,c(OH-)=c(H+),根据电荷守恒:c(NH4+)+c(H+)= 2c(A2-)+c(OH-),即c(NH4+)= 2c(A2-),故C错误;D、B点时,溶液应为0.025mol/L(NH4)2A溶液,
= 0,c(OH-)=c(H+),根据电荷守恒:c(NH4+)+c(H+)= 2c(A2-)+c(OH-),即c(NH4+)= 2c(A2-),故C错误;D、B点时,溶液应为0.025mol/L(NH4)2A溶液, 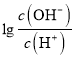 = -2,c(OH-)=10-2c(H+),c(OH-)=1.0×10-8 mol/L,c(H+)=1.0×10-6mol/L,溶液因NH4+水解呈酸性,NH4++ H2O
= -2,c(OH-)=10-2c(H+),c(OH-)=1.0×10-8 mol/L,c(H+)=1.0×10-6mol/L,溶液因NH4+水解呈酸性,NH4++ H2O![]() H++ NH3·H2O,该反应的水解常数为Kh=
H++ NH3·H2O,该反应的水解常数为Kh=![]() =
=![]() =
= ![]() =2×10-5,故氨水的电离平衡常数为
=2×10-5,故氨水的电离平衡常数为![]() =5×10-10,故D错误;故选B。
=5×10-10,故D错误;故选B。

【题目】如图装置可用于验证气体的某些化学性质,所得现象和结论均正确的是
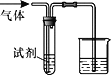
气体 | 试剂 | 现象 | 结论 | |
A | CH2=CH2 | 溴水 | 溶液褪色 | C2H4能与Br2发生取代反应 |
B | CO2 | BaCl2溶液 | 产生白色沉淀 | CO2能与可溶性钡盐反应 |
C | Cl2 | FeCl2溶液 | 溶液变为棕黄色 | 氧化性Cl2>Fe3+ |
D | SO2 | KMnO4溶液 | 溶液褪色 | SO2有漂白性 |
A. A B. B C. C D. D