题目内容
【题目】下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
a | |||||||||||||||||
b | c | d | e | ||||||||||||||
f | g | ||||||||||||||||
h | |||||||||||||||||
(1)请画出上述元素h的原子结构示意图_______;元素h位于元素周期表的第_____区。
(2)e、g两种元素的气态氢化物中更稳定的是_______(写化学式);
(3)b2a2分子的电子式是________ ,该分子中存在的σ键与π键的个数比为_______。
(4)c、d两种元素中第一电离能较大的是_________(写元素符号)。
(5)f和g两种元素形成的化合物是______(填“离子化合物”“共价化合物”)。a2d分子是_________分子(填极性分子或者非极性分子)。
【答案】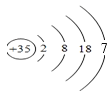 p HF
p HF ![]() 3:2 N 共价化合物 极性分子
3:2 N 共价化合物 极性分子
【解析】
由元素在周期表中位置,可知a为H、b为C、c为N、d为O、e为F、f为Al、g为Cl、h为Br。
(1)h为Br,原子核外有35个电子,有4个电子层,各层电子数为2、8、18、7;
(2)非金属性越强,氢化物越稳定;
(3)C2H2分子中C原子之间形成3对共用电子对,C原子与H原子之间形成1对共用电子对,其结构式为H-C≡C-H,单键为σ键、三键含有1个σ键、2个π键;
(4)同一周期的元素原子序数越大,第一电离能也越大,但第IIA、第VA元素处于全满、半满的稳定状态,第一电离能比相邻的元素大;
(5)Al、Cl形成的化合物是AlCl3,该物质是共价化合物,a2d分子是H2O,根据分子中原子的空间排列判断分子极性。
由元素在周期表中位置,可知a为H、b为C、c为N、d为O、e为F、f为Al、g为Cl、h为Br。
(1)h为Br,原子核外有35个电子,有4个电子层,各层电子数为2、8、18、7,原子结构示意图为 ;元素h位于元素周期表的第四周期第VIIA,属于p区;
;元素h位于元素周期表的第四周期第VIIA,属于p区;
(2)同主族自上而下非金属性减弱,非金属性F>Cl,元素的非金属性越强,其相应的简单氢化物越稳定,所以氢化物稳定性:HF>HCl,即HF更稳定;
(3) b2a2分子是C2H2,在该物质分子中C原子之间形成3对共用电子对,C原子与H原子之间形成1对共用电子对,电子式为:![]() ,结构式为H-C≡C-H,共价单键为σ键、共价三键含有1个σ键、2个π键,故σ键与π键的个数比为3:2;
,结构式为H-C≡C-H,共价单键为σ键、共价三键含有1个σ键、2个π键,故σ键与π键的个数比为3:2;
(4)N的电子排布式为1s22s22p3,2p轨道半充满,能量较低,较稳定,O的电子排布式为1s22s22p4,2p轨道易失去一个电子形成半充满的稳定状态,所以N元素第一电离能高于同周期相邻元素,即N、O两种元素中第一电离能较大的是N元素;
(5)Al、Cl形成的化合物是AlCl3,该物质是由分子构成的共价化合物,a2d分子是H2O,在水分子中两个H-O键之间的夹角是104.3°,分子空间排列不对称,因此该物质分子是极性分子。