题目内容
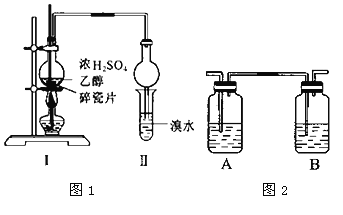
【题目】所示装置进行探究实验(浓硫酸和乙醇制备乙烯)。以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色。
(1)写出该实验中生成乙烯的化学方程式___________。
(2)甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成,且乙烯具有不饱和性,其理由正确的是_______。(填字母序号)
A.乙烯与溴水易发生取代反应 B.使溴水褪色的反应,未必是加成反应
C.使溴水褪色的物质,未必是乙烯 D.浓硫酸氧化乙醇生成乙醛,也会使溴水褪色
(3)乙同学经过细致观察后认为试管中另一现象可证明反应中有乙烯生成,这个现象是________。
(4)丙同学对上述实验装置进行了改进,在I和Ⅱ之间增加如图2所示装置,则A中的试剂应为___,其作用是_____。
【答案】CH3CH2OH![]() H2O+CH2=CH2↑ BC 液体分两层,下层有油状液体 NaOH溶液 吸收二氧化硫
H2O+CH2=CH2↑ BC 液体分两层,下层有油状液体 NaOH溶液 吸收二氧化硫
【解析】
乙醇与浓硫酸加热到170℃可以生成乙烯,将乙烯通入溴水后,乙烯可以与溴水发生加成反应而使溴水褪色;浓硫酸具有脱水性和强氧化性,能够将乙醇碳化,反应中有碳生成,在加热的条件下,碳与浓硫酸反应生成二氧化硫和二氧化硫,据此分析解答。
(1)乙醇在浓硫酸做催化剂脱水剂条件下加热到170℃生成乙烯和水,反应的方程式:CH3CH2OH![]() H2O+CH2=CH2↑,故答案为:CH3CH2OH
H2O+CH2=CH2↑,故答案为:CH3CH2OH![]() H2O+CH2=CH2↑;
H2O+CH2=CH2↑;
(2)浓H2SO4具有脱水性,将乙醇碳化,浓H2SO4还具有强氧化性,随后将碳氧化,自身被还原生成二氧化硫,C+2H2SO4![]() CO2↑+2SO2↑+2H2O,SO2具有还原性,可以与Br2发生氧化还原反应生成硫酸和氢硫酸而使溴水褪色,反应方程式为SO2+Br2+2H2O=2HBr+H2SO4。A.乙烯与溴水不容易发生取代反应,错误;B.使溴水褪色的反应,未必是加成反应,可能是二氧化硫与溴水的氧化还原反应,正确;C.使溴水褪色的物质,未必是乙烯,也可能是二氧化硫,正确;D.该反应中浓硫酸不能氧化乙醇生成乙醛,错误,故答案为:BC;
CO2↑+2SO2↑+2H2O,SO2具有还原性,可以与Br2发生氧化还原反应生成硫酸和氢硫酸而使溴水褪色,反应方程式为SO2+Br2+2H2O=2HBr+H2SO4。A.乙烯与溴水不容易发生取代反应,错误;B.使溴水褪色的反应,未必是加成反应,可能是二氧化硫与溴水的氧化还原反应,正确;C.使溴水褪色的物质,未必是乙烯,也可能是二氧化硫,正确;D.该反应中浓硫酸不能氧化乙醇生成乙醛,错误,故答案为:BC;
(3)溴水中的溴与反应生成的乙烯发生加成反应,方程式为:CH2=CH2+Br2→CH2BrCH2Br,1,2-二溴乙烷密度大于水且不溶于水,在试管底层为油状物质,该现象可以证明反应中有乙烯生成,故答案为:试管内液体分两层,底层有油状物质生成;
(4)二氧化硫能和溴发生氧化还原反应而使溴水褪色,从而干扰乙烯的检验,二氧化硫属于酸性氧化物,能和碱反应生成盐,为防止二氧化硫干扰乙烯的检验,可以用氢氧化钠溶液除去二氧化硫,二氧化硫能使品红溶液褪色,可以用品红溶液检验二氧化硫,实验时要先吸收二氧化硫,再检验二氧化硫是否被除尽,则A中的试剂是NaOH溶液,B中液体是品红溶液,故答案为:NaOH溶液;吸收SO2。

【题目】现有七种元素A、B、C、D、E、F、G,其中A、B、C为三个不同周期的短周期元素,E、F、G为第四周期元素。请根据下列相关信息,回答问题。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数与s电子数相等 |
C基态原子的价电子排布为nsn-1npn+1 |
D的能层数与C相同,且电负性比C大 |
E元素的主族序数与周期数的差为1,且第一电离能比同周期相邻两种元素都大 |
F是前四周期中电负性最小的元素 |
G在周期表的第五列 |
(1)C基态原子中能量最高的电子,其电子云在空间有____个方向,原子轨道呈____形,C简单离子核外有___种运动状态不同的电子。
(2)①一般情况下,同种物质为固态时密度大于其液态,但固态A2B的密度比其液态时小,原因是___;
②A2B2难溶于CS2,简要说明理由:________。
(3)G位于____族___区,它的一种氧化物常用于工业生产硫酸的催化剂,已知G在该氧化物中的化合价等于其价电子数,则该氧化物的化学式为____;
(4)ED3分子的VSEPR模型名称为____,其中E原子的杂化轨道类型为____。
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=____,ΔH=___(填“<”、“>”或“=”)0。
(2)830℃时,向一个5 L的密闭容器中充入0.20molA和0.80molB,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=____mol·L-1,C的物质的量为___mol;若反应经一段时间后,达到平衡时A的转化率为____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_____。
(3)判断该反应是否达到平衡的依据为_____。
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D