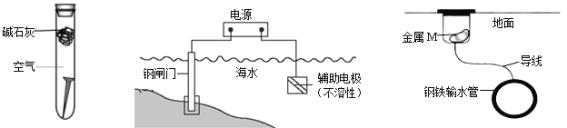
题目内容
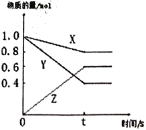
【题目】实验室用100mLNaOH溶液捕获CO2,一定时间后,测定CO2的吸收量。充分反应后,再向所得溶液中逐滴加入2.0mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示。回答下列问题:

(1)原NaOH溶液的物质的量浓度为______;
(2)题中通入CO2后所得溶液中的溶质有______,溶液中溶质的物质的量之比为______。
【答案】1.5mol/L Na2CO3和NaHCO3 1:1
【解析】
(1)加入75mL盐酸时二氧化碳的体积达最大,此时溶液为NaCl溶液,根据氯离子、钠离子守恒,所以n(NaOH)=n(NaCl)=n(HCl)=0.075L×2mol/L=0.15mol,所以c(NaOH)=0.15mol/0.1L=1.5mol/L,故答案为:1.5mol/L;
(2)当向100mLNaOH溶液中通入一定量的CO2气体时,发生的反应有:2NaOH+CO2=Na2CO3+H2O,还可能有:NaOH+CO2=NaHCO3,根据图象可知,由于无气体产生阶段消耗的盐酸为25mL,而有气体生成的阶段消耗的盐酸为50mL,可知溶液的成分为Na2CO3和NaHCO3的混合物;当向溶液中加盐酸的体积25mL时,无气体出现,说明此段内发生了如下反应:HCl+Na2CO3=NaHCO3+NaCl,再加盐酸时产生气体,即25mL-75mL共消耗50mL的盐酸,发生NaHCO3+HCl=CO2↑+NaCl+H2O,所以Na2CO3和NaHCO3的物质的量之比为1:1,故答案为:Na2CO3和NaHCO3;1:1。

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目