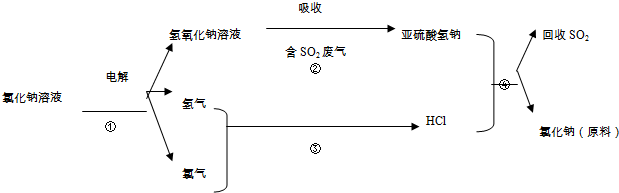
题目内容
2.下列物质的电子式正确的是( )| A. |  | B. | H+[O]2-H+ | C. | Na+[Cl]- | D. | Mg2+[F]$_2^-$ |
分析 A、氮原子最外层5个电子,氮原子间形成三对共用电子对;
B、水是共价化合物;
C、氯离子最外层8个电子;
D、镁元素化合价为+2价,氟离子-1价,氟离子最外层8个电子.
解答 解:A、氮原子最外层5个电子,氮原子间形成三对共用电子对,电子式为: ,故A正确;
,故A正确;
B、水是共价化合物,电子式为:水的电子式为: ,故B错误;
,故B错误;
C、氯离子最外层8个电子,电子式为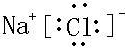 ,故C错误;
,故C错误;
D、镁元素化合价为+2价,氟离子-1价,氟离子最外层8个电子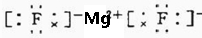 ,故D错误;
,故D错误;
故选A.
点评 本题考查了电子式的书写判断,题目难度中等,注意掌握电子式的概念及正确书写方法,明确离子化合物与共价化合物的电子式的表示方法与区别.

练习册系列答案
相关题目
2.下列离子方程式书写正确的是( )
| A. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| B. | 向AlCl3溶液中滴加氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Fe2O3与氢碘酸反应:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 向氯化亚铁溶液中滴加稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
3.下列反应(均已配平)中,氧化剂与还原剂物质的量的关系不是1:1的是( )
| A. | 3Cl2+6NaOH$\frac{\underline{\;△\;}}{\;}$5NaCl+NaClO3+3H2O | |
| B. | Fe+CuSO4=FeSO4+Cu | |
| C. | Cu+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O | |
| D. | 2Na+2HCl═2NaCl+H2↑ |
20.一定条件下,在容积为1L密闭容器发生可逆反应:A(g)+2B(g)?2C(g),实验测得当生成2mol C时,放出了QkJ的热量.若条件不变起始向容器中充入1mol C,则反应达平衡时的热效应为( )
| A. | 放出0.5QkJ的热量 | B. | 吸收0.5QkJ的热量 | ||
| C. | 放出的热量小于0.5QkJ | D. | 吸收的热量小于0.5QkJ |
7.NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,2.24L CCl4分子数目为0.1NA | |
| B. | 物质的量浓度为0.25mol/L的MgCl2溶液中,含有Cl-个数为0.5NA | |
| C. | 6.4g O2和O3的混合物中含有的氧原子数目为0.4NA | |
| D. | 用含3.01×1023个FeCl3的饱和溶液制备出的氢氧化铁胶体数目为0.5NA |
7.下列实验过程中,溶液的pH减小的是( )
| A. | 以碳棒为两极电解氢氧化钠溶液 | B. | 向稀盐酸中滴加NaOH溶液 | ||
| C. | 以碳棒为两极电解饱和氯化钠溶液 | D. | 向氢氧化钠溶液中加水 |
14.分别燃烧等物质的量的下列各组物质,其中消耗氧气的量相等的是( )
①C2H2与C2H4O ②C4H8与C6H12O6 ③C7H8与C6H12 ④HCOOCH3与CH3COOH.
①C2H2与C2H4O ②C4H8与C6H12O6 ③C7H8与C6H12 ④HCOOCH3与CH3COOH.
| A. | ①③④ | B. | ①②③④ | C. | ①④ | D. | ①②④ |
12.高炉冶铁工艺流程如图.在特殊的燃烧器中使氧气和天然气燃烧:
CH4(g)+2O2(g)═CO2(g)+2H2O(g)(放热反应),
催化反应室发生的反应为(不考虑其他平衡的存在):CH4(g)+H2O(g)?CO(g)+3H2(g)(吸热反应);CH4(g)+CO2(g)?2CO(g)+2H2(g)(吸热反应),
下列说法正确的是( )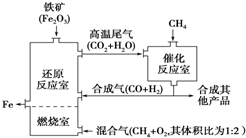
CH4(g)+2O2(g)═CO2(g)+2H2O(g)(放热反应),
催化反应室发生的反应为(不考虑其他平衡的存在):CH4(g)+H2O(g)?CO(g)+3H2(g)(吸热反应);CH4(g)+CO2(g)?2CO(g)+2H2(g)(吸热反应),
下列说法正确的是( )

| A. | 加入铁矿石时,将铁矿石粉碎,目的是加快反应速率提高原料利用率 | |
| B. | 增大催化反应室的压强,甲烷的转化率增大 | |
| C. | 设置燃烧室的目的是产生CO2和水蒸气作原料气与甲烷反应 | |
| D. | 催化反应室需维持在550~750℃,目的仅是提高CH4转化的速率 |