题目内容
14.下列关于化学反应与能量的说法正确的是( )| A. | 中和反应是放热反应 | |
| B. | 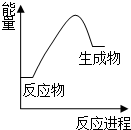 H2燃烧时的能量变化如图所示 | |
| C. | 化学键断裂放出能量 | |
| D. | 反应物总能量与生成物总能量一定相等 |
分析 A、中和反应都是放热反应;
B、物质燃烧时向外界释放能量属于放热反应;
C、化学键断裂吸收能量;
D、化学反应中有物质变化一定伴随有能量变化
解答 解:A、酸碱发生中和反应时向外界释放能量,所以中和反应都是放热反应,故A正确;
B、物质燃烧时向外界释放能量属于放热反应,所以反应物总能量大于生成物总能量,故B错误;
C、化学键断裂吸收能量,故C错误;
D、化学反应中有物质变化一定伴随有能量变化,反应物总能量与生成物总能量一定不相等,故D错误;
故选A.
点评 本题主要考查了放热与吸热反应的原因、常见的吸热和放热反应,是对基本知识的考查,较简单.

练习册系列答案
相关题目
4.设NA是阿伏加德罗常数的数值,下列说法不正确的是( )
| A. | 标准状况下,2.24 L Cl2溶于水,转移的电子数目为0.1NA | |
| B. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离总数是3 NA | |
| C. | 常温常压下,8 g SO3所含的氧原子的数目为0.3NA | |
| D. | 过氧化钠与H2O反应,每生成0.1mol氧气,转移电子的数目为0.2NA |
5.下列离子方程式正确的是( )
| A. | 用氯化铁溶液腐蚀印刷电路板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 过氧化钠与水反应制备氧气:Na2O2+2H2O═2N++2OH-+O2↑ | |
| C. | 硫酸亚铁溶液中通氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| D. | 用惰性电极电解饱和食盐水:2H++2Cl-═H2↑+Cl2↑ |
2.下列离子方程式书写正确的是( )
| A. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+═3Fe3++4H2O | |
| B. | 向AlCl3溶液中滴加氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | Fe2O3与氢碘酸反应:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 向氯化亚铁溶液中滴加稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
9.下列物质中含有离子键的是( )
| A. | Na | B. | CO2 | C. | SiO2 | D. | KCl |
19.现有一定量的Cu和CuO混合物,向其中加入0.6L 2.0mol/L稀硝酸,混合物完全溶解,同时生成4.48L NO(标准状况).向所得溶液中加入一定体积1.0mol/L NaOH溶液,恰好使Cu2+沉淀完全,沉淀经洗涤、充分灼烧后得32.0g固体.(忽略溶液的体积变化).
下列说法正确的是( )
下列说法正确的是( )
| A. | 该混合物中铜的质量为19.2 g | |
| B. | 与该混合物反应消耗的HNO3的量为1.2 mol | |
| C. | 加入NaOH溶液的体积是800 mL | |
| D. | Cu2+沉淀完全后,溶液中c(NO3-)为0.7 mol/L |
6.下列所含分子数由多到少的排列顺序是( )
①1.5mol H2 ②所含原子的物质的量为4mol的H2 ③45g H2O ④16g O2.
①1.5mol H2 ②所含原子的物质的量为4mol的H2 ③45g H2O ④16g O2.
| A. | ①②③④ | B. | ③②①④ | C. | ②③①④ | D. | ②①③④ |
3.下列反应(均已配平)中,氧化剂与还原剂物质的量的关系不是1:1的是( )
| A. | 3Cl2+6NaOH$\frac{\underline{\;△\;}}{\;}$5NaCl+NaClO3+3H2O | |
| B. | Fe+CuSO4=FeSO4+Cu | |
| C. | Cu+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O | |
| D. | 2Na+2HCl═2NaCl+H2↑ |