题目内容
18.已知某分子晶体晶胞的8个顶点和6个面的中心上各有一个分子,试回答下列问题:(1)若用“●”表示该分子,请画出该晶体的晶胞示意图.
(2)下列物体可形成上述晶体结构的是AD(填字母)
A.CO2 B.H2O C.SiO2 D.C60
(3)CO2、SiO2、CS2三种晶体的熔点右高到低的顺序是SiO2>CS2>CO2;
(4)若该分子的摩尔质量为M g•mol-1,晶体的密度为ρg•cm-3,阿伏加德罗常数为NA mol-1,则该晶体晶胞的边长为$\root{3}{\frac{4M}{{N}_{A}ρ}}$cm.
分析 (1)根据题中条件,在立方体的面心上和顶点上各画一个“●”;
(2)CO2晶体中分子分布在晶胞的8个顶点和6个面的中心上,H2O的晶胞结构如图 晶胞内部有分子,SiO2是原子晶体,晶内部也有原子,C60晶体中,C60分子分布在晶胞的8个顶点和6个面的中心上,据此答题;
晶胞内部有分子,SiO2是原子晶体,晶内部也有原子,C60晶体中,C60分子分布在晶胞的8个顶点和6个面的中心上,据此答题;
(3)原子晶体的熔点高于分子晶体,在分子晶体中,结构相似的物质,相对分子质量越大,熔点越高,据此判断;
(4)根据V=$\frac{m}{ρ}$计算出晶胞的体积,进而确定晶胞的边长.
解答 解:(1)根据题中条件,在立方体的面心上和顶点上各画一个“●”如图所示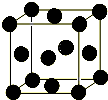 ,
,
故答案为: ;
;
(2)CO2晶体中分子分布在晶胞的8个顶点和6个面的中心上,H2O的晶胞结构如图 晶胞内部有分子,SiO2是原子晶体,晶内部也有原子,C60晶体中,C60分子分布在晶胞的8个顶点和6个面的中心上,
晶胞内部有分子,SiO2是原子晶体,晶内部也有原子,C60晶体中,C60分子分布在晶胞的8个顶点和6个面的中心上,
故选:AD;
(3)原子晶体的熔点高于分子晶体,在分子晶体中,结构相似的物质,相对分子质量越大,熔点越高,SiO2是原子晶体,CO2、CS2是分子晶体,所以CO2、SiO2、CS2三种晶体的熔点右高到低的顺序是SiO2>CS2>CO2,
故答案为:SiO2>CS2>CO2;
(4)该分子的晶胞中含有的分子数为$8×\frac{1}{8}+6×\frac{1}{2}$=4,所以V=$\frac{m}{ρ}$=$\frac{\frac{4M}{{N}_{A}}}{ρ}$cm3=$\frac{4M}{{N}_{A}ρ}$cm3,所以晶胞的边长为$\root{3}{\frac{4M}{{N}_{A}ρ}}$cm,
故答案为:$\root{3}{\frac{4M}{{N}_{A}ρ}}$.
点评 本题主考查晶胞的计算、晶体的结构、不同类型晶体的性质等知识,难度不大,答题时注意物质结构基础知识的灵活运用.

| A. | 氧气发生氧化反应 | |
| B. | 每转移2mol电子,电池内增加2molH2O | |
| C. | C正极附近c(H+)增大 | |
| D. | 负极附近溶液的pH值降低 |
| A. | Na | B. | CO2 | C. | SiO2 | D. | KCl |
①1.5mol H2 ②所含原子的物质的量为4mol的H2 ③45g H2O ④16g O2.
| A. | ①②③④ | B. | ③②①④ | C. | ②③①④ | D. | ②①③④ |
| A. | NaCl溶液与CH3COOHNH4溶液均显中性,两溶液中水的电离程度相同 | |
| B. | CH3COONa溶液加水稀释:$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$减小 | |
| C. | 在NaHSO3溶液中,c(H+)+c(H2SO3)=c(OH-)+c(SO32-) | |
| D. | 含有AgCl和AgBr固体的悬浊液:c(Ag+)>c(Cl-)=c(Br-) |
| A. | 3Cl2+6NaOH$\frac{\underline{\;△\;}}{\;}$5NaCl+NaClO3+3H2O | |
| B. | Fe+CuSO4=FeSO4+Cu | |
| C. | Cu+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O | |
| D. | 2Na+2HCl═2NaCl+H2↑ |
| A. | 标准状况下,2.24L CCl4分子数目为0.1NA | |
| B. | 物质的量浓度为0.25mol/L的MgCl2溶液中,含有Cl-个数为0.5NA | |
| C. | 6.4g O2和O3的混合物中含有的氧原子数目为0.4NA | |
| D. | 用含3.01×1023个FeCl3的饱和溶液制备出的氢氧化铁胶体数目为0.5NA |
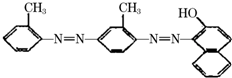 据中央电视台每周质量报告报道.北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物.“苏丹红Ⅳ号”的结构简式如图.下列关于“苏丹红Ⅳ号”说法正确的是( )
据中央电视台每周质量报告报道.北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物.“苏丹红Ⅳ号”的结构简式如图.下列关于“苏丹红Ⅳ号”说法正确的是( )| A. | 属于芳香烃 | B. | 属于苯的同系物 | C. | 属于氨基酸 | D. | 能发生加成反应 |