题目内容
20.如图是无机物A~N在一定条件下的转化关系(部分产物及反应条件未列出).M的溶液与C的稀溶液发生以下反应.其中,I的单质能与本周期IA、VIIA元素组成的最高价氧化物的水化物分别发生反应,K是一种红棕色气体,E.是红褐色沉淀E物质,N是由两种元素按质量比7:8组成的常用化工原料.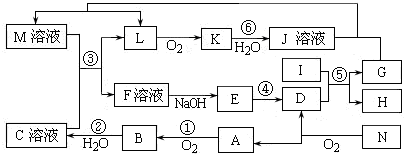
请填写下列空白:
(1)物质M、N的化学符号分别为Fe(NO3)2、FeS2;
(2)在反应①、②、④、⑥中,既属于化合反应又属于非氧化还原反应的是①(填写序号);在反应⑤中氧化剂与还原剂的物质的量之比为1:2;
(3)反应③的离子方程式是:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;I与氢氧化钠反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2GO4,同时还生成KNO2和H2O.该反应的化学方程式是(用相应元素表示):Fe2O3+3KNO3+2KOH$\frac{\underline{\;高温\;}}{\;}$K2FeO4+3KNO2+H2O.
分析 I的单质能与本周期IA、VIIA元素组成的最高价氧化物的水化物分别发生反应,应是氢氧化铝与强酸、强碱的反应,故I为Al;F与氢氧化钠反应得到E是红褐色的沉淀物质,则E为Fe(OH)3;L与氧气反应得到K,K是一种红棕色气体,则L为NO、K为NO2,K与水反应生成J为HNO3;N是由两种元素按质量比7:8组成的常用化工原料,与氧气反应得到D与A,A可以连续发生氧化反应,D由氢氧化铁转化得到,考虑为工业制备硫酸反应,猜测N为FeS2,Fe、S元素质量之比符合7:8,故A为SO2,D为Fe2O3,B为SO3,C为H2SO4;又由G+HNO3 →M+NO↑,可知G为Fe,H为Al2O3,而M与C反应得到NO与F,则M为Fe(NO3)2,则F为铁盐,可能为Fe(NO3)3或Fe2(SO4)3,据此解答.
解答 解:I的单质能与本周期IA、VIIA元素组成的最高价氧化物的水化物分别发生反应,应是氢氧化铝与强酸、强碱的反应,故I为Al;F与氢氧化钠反应得到E是红褐色的沉淀物质,则E为Fe(OH)3;L与氧气反应得到K,K是一种红棕色气体,则L为NO、K为NO2,K与水反应生成J为HNO3;N是由两种元素按质量比7:8组成的常用化工原料,与氧气反应得到D与A,A可以连续发生氧化反应,D由氢氧化铁转化得到,考虑为工业制备硫酸反应,猜测N为FeS2,Fe、S元素质量之比符合7:8,故A为SO2,D为Fe2O3,B为SO3,C为H2SO4;又由G+HNO3 →M+NO↑,可知G为Fe,H为Al2O3,而M与C反应得到NO与F,则M为Fe(NO3)2,则F为铁盐,可能为Fe(NO3)3或Fe2(SO4)3.
(1)由上述分析可知,物质M、N的化学符号分别为:Fe(NO3)2、FeS2,故答案为:Fe(NO3)2、FeS2;
(2)在反应①、②、④、⑥中,①、⑥都为氧化还原反应,①为2SO2+O2→2SO3的反应,既属于化合反应又属于非氧化还原反应,
反应⑤为Al与Fe2O3所发生的置换反应,方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,氧化剂与还原剂的物质的量之比为1:2,
故答案为:①;1:2;
(3)反应③的离子方程式是:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;I为Al,与NaOH反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)将化合物Fe2O3与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2GO4,同时还生成KNO2和H2O,该反应的化学方程式是:Fe2O3+3KNO3+2KOH$\frac{\underline{\;高温\;}}{\;}$K2FeO4+3KNO2+H2O,
故答案为:Fe2O3+3KNO3+2KOH$\frac{\underline{\;高温\;}}{\;}$K2FeO4+3KNO2+H2O.
点评 本题考查无机物的推断,涉及N、S、Fe、Al元素化学性质与转化,I的性质、K与E的颜色及转化关系中连续与氧气等是推断突破口,是对学生综合能力的考查,难度中等.

| A. | 混合气体的密度不再改变的状态 | |
| B. | 单位时间生成2n mol C,同时生成n mol D | |
| C. | 混合气体的压强不再改变的状态 | |
| D. | A、B、C、D的分子数之比为1:3:2:1 |
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
A.容器内压强不变
B.CO的消耗速率等于CO2的生成速率
C.混合气体中CO的体积分数不变
D.c(CO2):c(H2)=1:l
(2)上表中:cl=0.08mol/L.
| A. | 0.1mol/L (NH4)2SO4溶液中:c(SO42-)<c(NH4+) | |
| B. | 相同温度下,0.6 mol/L 氨水溶液与0.3 mol/L 氨水溶液中c(OH-)之比是2:1 | |
| C. | 向0.1 mol/L NaNO3溶液中滴加稀HNO3使溶液中pH=5,则混合溶液中c(Na+)<c(NO3-) | |
| D. | 常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)<c(CH3COO-) |
| A. | 测得这种液体的pH值等于7 | |
| B. | 在1.01×105Pa的压强下测得其沸点为373K | |
| C. | 电解这种液体,在阴极得到的气体体积为阳极气体体积的两倍 | |
| D. | 测得该液体不导电 |
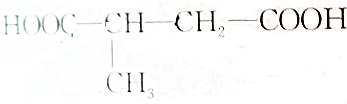 ,该烯烃的结构简式和名称为CH3CH═CHCH(CH3)CH2CH═CHCH2CH3,4-甲基-2,7-壬二烯.
,该烯烃的结构简式和名称为CH3CH═CHCH(CH3)CH2CH═CHCH2CH3,4-甲基-2,7-壬二烯.