题目内容
1.工业碳酸钠由于在生产过程中原料盐和工艺等的原因,常会含有Na2SO4、NaCl中的一种或两种杂质.现有工业碳酸钠样品,某化学兴趣小组就工业碳酸钠中是否含有这两种杂质进行探究.实验室有以下的仪器和药品可供使用:
烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹:1.0mol•L-1H2SO4、1.0mol•L-1HNO3、1.0mol•L-1HCl、NaOH稀溶液、0.1mol•L-1AgNO3、0.1mol•L-1BaCl2、0.1mol•LBa(NO3)2、蒸馏水.以下是部分实验探究过程:
(1)提出假设:根据题意,工业碳酸钠中含有杂质有3种可能的情况.
(2)设计实验方案
基于工业碳酸钠中两种杂质均存在这一假设,设计出实验方案(不要在答题卡上作答).
(3)根据(2)的实验方案,进行实验.请在答题卡上按下表格式写出实验操作步骤、预期的现象及结论
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② | ||
| ③ | ||
分析 (1)含有Na2SO4、NaCl中的一种或两种杂质,则可能为只有Na2SO4,只有NaCl,或Na2SO4、NaCl都有;
(3)检验碳酸钠可以和酸反应生成二氧化碳气体;
白色且不溶于硝酸的沉淀有硫酸钡和氯化银两种;
能和硝酸酸化的硝酸银反应生成白色沉淀的是含有氯离子的化合物,如加入硝酸钡生成沉淀,则说明含有Na2SO4.
解答 解:(1)含有Na2SO4、NaCl中的一种或两种杂质,则可能为只有Na2SO4,只有NaCl,或Na2SO4、NaCl都有,共3种,故答案为:3;
(3)①只有碳酸钠可以和酸反应生成二氧化碳气体,可以用硝酸检验是否生成二氧化碳气体来检验碳酸钠的存在;
②向酸化后的试管中加入0.1mol•L-1的Ba(NO3)2 溶液至过量,生成的白色且不溶于硝酸的沉淀是硫酸钡,证明含有硫酸钠;
③能和硝酸酸化的硝酸银反应生成的白色沉淀一定是氯化银,证明含有氯化钠,
故答案为:
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 取少许样品于试管中,加蒸馏水溶解.向试管中加足量的1.0 mol•L-1HNO3.(或加入1.0 mol•L-1HNO3至溶液中不再有气体放为止) | 有气体产生,说明样品中含有Na2CO3. |
| ② | 向试管中加入0.1 mol•L-1的Ba(NO3)2 溶液.若有沉淀产生,则继续加入0.1 mol•L-1Ba(NO3)2至过量. | 有沉淀产生,则含Na2SO4 |
| ③ | 将试管静置片刻后,取上层清液于另一去试管中,加入0.1 mol•L-1AgNO3溶液. | 有沉淀产生,则含NaCl. |
点评 本题考查物质检验、鉴别的实验方案的设计,侧重离子检验及实验探究的考查,注意混合物中一定存在、一定不存在和可能存在的是什么物质,题目难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
12.下列各组离子:
(1)K+、Fe2+、SO42-、ClO- (2)K+、Al3+、Cl-、HCO3-
(3)ClO-、Cl-、K+、OH- (4)Fe3+、Cu2+、SO42-、Cl-
(5)Na+、K+、AlO2-、HCO3- (6)Ca2+、Na+、SO42-、CO32-
在水溶液中能大量共存的是( )
(1)K+、Fe2+、SO42-、ClO- (2)K+、Al3+、Cl-、HCO3-
(3)ClO-、Cl-、K+、OH- (4)Fe3+、Cu2+、SO42-、Cl-
(5)Na+、K+、AlO2-、HCO3- (6)Ca2+、Na+、SO42-、CO32-
在水溶液中能大量共存的是( )
| A. | (1)和(6) | B. | (3)和(4) | C. | (2)和(5) | D. | (1)和(4) |
16.K、Ka或Kb、KW、Ksp分别表示化学平衡常数、电离常数、水的离子积、溶度积常数,下列关于这些常数的说法中,正确的是( )
| A. | 化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关 | |
| B. | 已知:K1 (H2CO3)>Ka (HClO)>K2(H2CO3),向NaClO溶液中通入少量CO2的化学方程是:2NaClO+CO2+H2O=Na2CO3+2HClO | |
| C. | 25℃时,pH=4的盐酸中,KW=10-20 | |
| D. | 常温下,Ksp(CaSO4)=9×10-6,向100mL饱和CaSO4溶液中加400mL 0.01mol/LNa2SO4溶液,无沉淀析出 |
6.NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 5.6 g铁与足量氯气完全反应转移的电子数为0.2NA | |
| B. | 100 mL 2.0 mol•L-1的盐酸与醋酸溶液中氢离子均为0.2NA | |
| C. | 标准状况下,22.4 L CO2与22.4 L H2O所含原子数均为3 NA | |
| D. | 体积分别为1.0L pH=2的盐酸与硫酸溶液中氢离子数均为0.01NA |
13.下列有关物质性质的比较中,正确的是( )
| A. | 熔点:CO2<H2O<SiO2<KCl | B. | 还原性:S2->I->Br->Cl- | ||
| C. | 酸性:H3PO4>H2SO4>HClO4>H2SiO3 | D. | 稳定性:H2O<NH3<PH3<SiH4 |
13.如表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为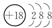 .
.
(2)表中能形成两性氢氧化物的元素是铝(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为(用化学式表示)KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4.
(4)③元素与⑩元素两者核电荷数之差是26.
(5)请写出②的氢化物发生催化氧化的化学方程式4NH3+5O2 4NO+6H2O.
4NO+6H2O.
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
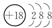 .
.(2)表中能形成两性氢氧化物的元素是铝(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为(用化学式表示)KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4.
(4)③元素与⑩元素两者核电荷数之差是26.
(5)请写出②的氢化物发生催化氧化的化学方程式4NH3+5O2
 4NO+6H2O.
4NO+6H2O.  ,该烯烃的结构简式和名称为CH3CH═CHCH(CH3)CH2CH═CHCH2CH3,4-甲基-2,7-壬二烯.
,该烯烃的结构简式和名称为CH3CH═CHCH(CH3)CH2CH═CHCH2CH3,4-甲基-2,7-壬二烯.