题目内容
16.下列与化学反应能量变化相关的叙述正确的是( )| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 放热反应在常温时即可发生,吸热反应必须加热才能发生 | |
| C. | 反应物总能量高于生成物总能量的反应是吸热反应 | |
| D. | 反应是吸热还是放热决定于断键时吸收的能量与成键时放出能量的相对大小 |
分析 A、化学反应过程中一定伴随能量变化,反应可以是放热反应或吸热反应;
B、反应放热还是吸热与反应条件无关,决定于反应物和生成物的能量高低;
C、放热反应实质是反应物所具有的总能量高于生成物所具有的总能量;
D、根据断键时吸收的能量与成键时放出能量的相对大小决定了反应是放出能量还是吸收能量.
解答 解:A、化学反应过程中一定伴随能量变化,反应可以是放热反应或吸热反应,反应物能量可以高于生成物反应放热,反应物能量低于生成物,反应吸热反应,故A错误;
B、氯化铵与氢氧化钡反应吸热但不需要任何条件,铝热反应要在高温下才能进行,但属于发热反应,故B错误;
C、反应物的总能量高于生成物的总能量的反应属于放热反应,故C错误;
D、因断键时吸收的能量与成键时放出能量的相对大小决定了反应是放出能量还是吸收能量,故D正确;
故选:D.
点评 本题主要考查了化学反应中能量变化的原因,需要强调的是反应是吸热反应还是放热反应与反应的条件无关.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.如图曲线图(纵坐标为沉淀的量,横坐标为加入物的量)不正确的是( )
| A. |  向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液加入0.1 mol/L稀H2SO4溶液 向1L浓度均为0.1mol/L的Ba(OH)2、NaAlO2混合液加入0.1 mol/L稀H2SO4溶液 | |
| B. |  向含有0.1 mol/L AlCl3和0.3mol/L NH4Cl的混合液1L中加入0.1mol/L NaOH溶液 向含有0.1 mol/L AlCl3和0.3mol/L NH4Cl的混合液1L中加入0.1mol/L NaOH溶液 | |
| C. |  向氢氧化钠溶液滴加明矾[KAl(SO4)2]溶液,[已知AlO2-和Al3+在溶液中生成Al(OH)3] 向氢氧化钠溶液滴加明矾[KAl(SO4)2]溶液,[已知AlO2-和Al3+在溶液中生成Al(OH)3] | |
| D. |  向AlCl3溶液滴加过量氨水 向AlCl3溶液滴加过量氨水 |
4.由一个O,一个N,7个H和若干个碳原子组成的有机物,其碳原子的个数至少为( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
1.如图为铜锌原电池示意图,下列说法正确的是( )
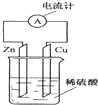

| A. | 电子由铜片通过导线流向锌片 | B. | 锌片逐渐溶解 | ||
| C. | 烧杯中溶液逐渐呈蓝色 | D. | 该装置能将电能转变为化学能 |
8.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=13的溶液:K+、Na+、Cl-、SiO32- | |
| B. | c(H+)/c(OH-)=1×10-14的溶液:Na+、NH4+、Cl-、SO42- | |
| C. | 0.1mol•L-1的Na2CO3溶液:Na+、Ca2+、I-、SO42- | |
| D. | 加入石蕊呈蓝色的溶液:Na+、Al3+、Cl-、NO3- |
5.a g CO 和H2的混合气体在足量O2中完全燃烧后,将产生的CO2和水蒸气通入过量的过氧化钠被其完全吸收,问过氧化钠固体质量增加多少g.( )
| A. | a g | B. | 0.5a g | C. | 4.4a g | D. | 1.8a g |
 E的元素符号是Cl.
E的元素符号是Cl.