题目内容
5.a g CO 和H2的混合气体在足量O2中完全燃烧后,将产生的CO2和水蒸气通入过量的过氧化钠被其完全吸收,问过氧化钠固体质量增加多少g.( )| A. | a g | B. | 0.5a g | C. | 4.4a g | D. | 1.8a g |
分析 利用差量法,根据化学方程式分析:CO与H2在氧气中完全燃烧,生成CO2和H2O,生成的CO2和H2O再与Na2O2反应;2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,一氧化碳与二氧化碳物质的量相等,Na2O2与CO2反应2CO2+2Na2O2=2Na2CO3+O2,质量增重△m为2Na2CO3-2Na2O2=2CO,可知,反应后固体质量增加量为CO的质量;2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,生成的水与氢气物质的量相等,Na2O2与H2O反应2H2O+2Na2O2=4NaOH+O2,质量增重△m为2H2O-O2=2H2,可知,反应后固体增加的质量为氢气质量.
解答 解:CO和H2的混合气体燃烧的方程式:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,与Na2O2反应的方程式:2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2,通过方程式可以看出,固体质量的增加量就是原混合气体的质量,为ag,
故选A.
点评 本题考查混合物的计算,题目难度不大,注意本题看似要用到CO、H2与O2反应,CO2、H2O与Na2O2的反应等,实质上题目后面的叙述是干扰.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
15.取某铁的氧化物样品,用140mL 5mol/L盐酸恰好使其完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中的Fe2+ 完全转化为 Fe3+,该样品中可能的化学式是( )
| A. | Fe3O4 | B. | Fe4O5 | C. | Fe5O6 | D. | Fe5O7 |
16.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 放热反应在常温时即可发生,吸热反应必须加热才能发生 | |
| C. | 反应物总能量高于生成物总能量的反应是吸热反应 | |
| D. | 反应是吸热还是放热决定于断键时吸收的能量与成键时放出能量的相对大小 |
13.在一定温度下的在2L密闭容器中加入一定量的炭和水蒸气发生如下反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0,可认定该可逆反应在一定条件下已达到化学平衡状态的是( )
| A. | 容器中H2O、CO、H2的物质的量之比为1:1:1 | |
| B. | v正(CO)=v逆(H2O) | |
| C. | 生成n molCO的同时生成n mol H2 | |
| D. | 1mol H-H键断裂同时生成2mol H-O键 |
17.向a g锌和铜的混合物中加入适量的稀硝酸,恰好完全反应,假定生成气体只有NO,其标准状况下的体积为b L.向反应后的溶液中加入c mol•L-1氢氧化钠溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为d g.再将得到的沉淀灼烧至质量不再改变为止,得到固体e g.则下列关系不正确的是( )
| A. | c=$\frac{3b}{0.0224V}$ | B. | e=a+$\frac{8cV}{1000}$ | C. | d=a+$\frac{17cV}{1000}$ | D. | $\frac{82a}{65}$<e<$\frac{5a}{4}$ |
3.目前我省不少城市居民所使用的燃料主要是管道煤气,有的地方已经开始使用天然气作为民用燃料.管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4.它们的燃烧反应如下:
2CO+O2$\stackrel{点燃}{→}$2CO2 2H2+O2$\stackrel{点燃}{→}$2H2O CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是天然气.因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是增大进风口(填增大或减小),如不作改进可能产生的不良结果是天然气不能充分燃烧,可能生成有毒的CO
管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:
试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是丁烷遇冷凝结为液体使管道内气流不畅.
2CO+O2$\stackrel{点燃}{→}$2CO2 2H2+O2$\stackrel{点燃}{→}$2H2O CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是天然气.因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是增大进风口(填增大或减小),如不作改进可能产生的不良结果是天然气不能充分燃烧,可能生成有毒的CO
管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:
| 乙烷 | 丙烷 | 丁烷 | |
| 熔点(℃) | -183.3 | -189.7 | -138.4 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 |
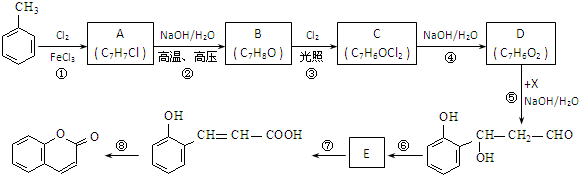
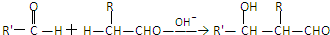 .
. .
. .
. 既可发生酯化反应生成香豆素,可发生加聚反应.该物质加聚产物的结构简式为
既可发生酯化反应生成香豆素,可发生加聚反应.该物质加聚产物的结构简式为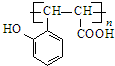 .
.
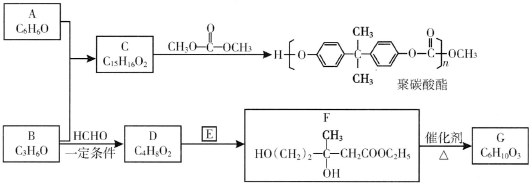
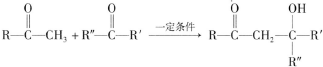 (R、R′、R″为氢原子或烃基)
(R、R′、R″为氢原子或烃基)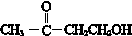 ,E的分子式是C4H8O2,F生成G的反应类型是取代反应?
,E的分子式是C4H8O2,F生成G的反应类型是取代反应?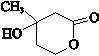 .G的同分异构体有多种,其中和G具有完全相同环状结构的同分异构体有23种(不包含G,不考虑立体异构).
.G的同分异构体有多种,其中和G具有完全相同环状结构的同分异构体有23种(不包含G,不考虑立体异构).