题目内容
1.如图为铜锌原电池示意图,下列说法正确的是( )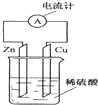
| A. | 电子由铜片通过导线流向锌片 | B. | 锌片逐渐溶解 | ||
| C. | 烧杯中溶液逐渐呈蓝色 | D. | 该装置能将电能转变为化学能 |
分析 由图中的铜锌原电池可知,Zn活泼,则Zn作负极,Cu作正极,发生电池反应为Zn+H2SO4═ZnSO4+H2↑,电子由负极流向正极,该装置将化学能转变为电能,以此来解答.
解答 解:A.Zn作负极,Cu作正极,则电子由锌片通过导线流向铜片,故A错误;
B.因Zn作负极,则Zn失去电子而逐渐溶解,故B正确;
C.由发生电池反应为Zn+H2SO4═ZnSO4+H2↑,Cu不反应,则烧杯中溶液为无色,故C错误;
D.该装置通过化学反应将化学能转变为电能,故D错误.
故选B.
点评 本题考查原电池的工作原理,明确电极的判断、电极反应、电池反应、能量转化等即可解答,难度不大.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案
相关题目
12.在密闭容器中进行如下反应:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.3mol•L-1、0.2mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度不可能的是( )
| A. | Z为0.3 mol•L-1 | |
| B. | X2为0.15 mol•L-1,Z为0.1 mol•L-1 | |
| C. | c(X2)+c(Y2)+c(Z)=0.6 mol•L-1 | |
| D. | c(X2)+c(Y2)+c(Z)=0.55 mol•L-1 |
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,71 g Cl2含有2 NA个Cl原子 | |
| B. | 把40 g NaOH固体溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol•L-1 | |
| C. | 物质的量浓度为1 mol/L的K2SO4溶液中,含2 NA个K+ | |
| D. | 常温常压下,11.2 L N2中含有的分子数为0.5 NA |
16.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 放热反应在常温时即可发生,吸热反应必须加热才能发生 | |
| C. | 反应物总能量高于生成物总能量的反应是吸热反应 | |
| D. | 反应是吸热还是放热决定于断键时吸收的能量与成键时放出能量的相对大小 |
13.在一定温度下的在2L密闭容器中加入一定量的炭和水蒸气发生如下反应:C(s)+H2O(g)?CO(g)+H2(g)△H>0,可认定该可逆反应在一定条件下已达到化学平衡状态的是( )
| A. | 容器中H2O、CO、H2的物质的量之比为1:1:1 | |
| B. | v正(CO)=v逆(H2O) | |
| C. | 生成n molCO的同时生成n mol H2 | |
| D. | 1mol H-H键断裂同时生成2mol H-O键 |
20.以下实验能获得成功的是( )
| A. | 要检验溴乙烷中的溴元素,可以加入NaOH溶液共热,冷却后滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| B. | 要检验蔗糖的水解产物,将蔗糖的水解液加入到新制的氢氧化铜悬浊液中,加热至沸腾观察是否有红色沉淀产生 | |
| C. | 在进行溴乙烷与NaOH乙醇溶液反应的实验中,将反应产生的气体直接通入到酸性高锰酸钾溶液中来检验产生的气体是否为乙烯 | |
| D. | 将铜丝在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,铜丝恢复成原来的红色,取出,铜丝又会变为黑色,反复几次,用氢氧化铜悬浊液可以证明是否生成了乙醛 |
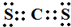 .
.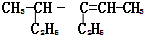 的系统命名:4-甲基-3-乙基-2-己烯
的系统命名:4-甲基-3-乙基-2-己烯 的分子式:C4H8O
的分子式:C4H8O