题目内容
7.(1)现有下列状态的物质①干冰 ②NaCl晶体 ③氨水 ④冰醋酸 ⑤酒精水溶液 ⑥铜 ⑦熔融的KOH ⑧蔗糖,其中属于电解质的是②④⑦,能导电的是③⑥⑦.(2)配平方程式3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,在该反应中,硝酸表现的性质有酸性和氧化性,还原剂与氧化剂的物质的量之比为:3:2.
分析 (1)在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液里和熔融状态下都不导电的化合物是非电解质,含有自由移动电子或离子的物质能导电;
(2)该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+2价,其得失电子最小公倍数是6,所以铜是还原剂、部分硝酸是氧化剂,还原剂发生氧化反应、氧化剂发生还原反应,以此来解答.
解答 解:(1)②④⑦在水溶液里或熔融状态下能电离出阴阳离子而使其水溶液或熔融状态导电,所以属于电解质;
①的水溶液能电离出阴阳离子的是碳酸,所以二氧化碳是非电解质,⑧蔗糖在水溶液里或熔融状态下以分子存在,所以其水溶液或熔融状态不导电,为非电解质;
③⑦中含有自由移动的离子,⑥中含有自由移动的电子,所以能导电;
氨水是混合物,铜是单质,所以氨水和铜既不是电解质也不是非电解质,故答案为:②④⑦;③⑥⑦;
(2)该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+2价,其得失电子最小公倍数是6,则配平方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,Cu元素失电子被氧化,该反应中铜是还原剂,则氧化产物是Cu(NO3)2,N元素得到电子,则HNO3为氧化剂,由电子守恒可知还原剂与氧化剂的物质的量之比为之比是=3:2,所以硝酸表现的性质有酸性和氧化性;
故答案为:3,8,3,2,4; 酸性和氧化性;3:2.
点评 本题考查了电解质和非电解质的判断、氧化还原反应,为高频考点,注意从元素化合价变化来分析解答,侧重分析与计算能力的综合考查,题目难度不大.

练习册系列答案
相关题目
18.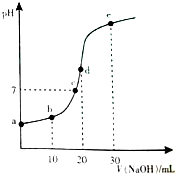 向20mL 0.1mol•L-1的CH3COOH溶液逐滴加入0.1mol•L-1NaOH溶液,pH变化曲线如图所示,下列说法错误的( )
向20mL 0.1mol•L-1的CH3COOH溶液逐滴加入0.1mol•L-1NaOH溶液,pH变化曲线如图所示,下列说法错误的( )
 向20mL 0.1mol•L-1的CH3COOH溶液逐滴加入0.1mol•L-1NaOH溶液,pH变化曲线如图所示,下列说法错误的( )
向20mL 0.1mol•L-1的CH3COOH溶液逐滴加入0.1mol•L-1NaOH溶液,pH变化曲线如图所示,下列说法错误的( )| A. | 在a点,溶液pH>1 | |
| B. | 在b点,CH3COOH的Ka≈c(H+) | |
| C. | 在c点,c(CH3COO-)=c(Na+)=0.1 mol•L-1 | |
| D. | 在d点,c(CH3COO-)+c(CH3COOH)=c(Na+) |
15.取某铁的氧化物样品,用140mL 5mol/L盐酸恰好使其完全溶解,所得溶液还能吸收标准状况下0.56L氯气,使其中的Fe2+ 完全转化为 Fe3+,该样品中可能的化学式是( )
| A. | Fe3O4 | B. | Fe4O5 | C. | Fe5O6 | D. | Fe5O7 |
12.在密闭容器中进行如下反应:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol•L-1、0.3mol•L-1、0.2mol•L-1,在一定条件下,当反应达到平衡时,各物质的浓度不可能的是( )
| A. | Z为0.3 mol•L-1 | |
| B. | X2为0.15 mol•L-1,Z为0.1 mol•L-1 | |
| C. | c(X2)+c(Y2)+c(Z)=0.6 mol•L-1 | |
| D. | c(X2)+c(Y2)+c(Z)=0.55 mol•L-1 |
16.下列与化学反应能量变化相关的叙述正确的是( )
| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 放热反应在常温时即可发生,吸热反应必须加热才能发生 | |
| C. | 反应物总能量高于生成物总能量的反应是吸热反应 | |
| D. | 反应是吸热还是放热决定于断键时吸收的能量与成键时放出能量的相对大小 |
17.向a g锌和铜的混合物中加入适量的稀硝酸,恰好完全反应,假定生成气体只有NO,其标准状况下的体积为b L.向反应后的溶液中加入c mol•L-1氢氧化钠溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为d g.再将得到的沉淀灼烧至质量不再改变为止,得到固体e g.则下列关系不正确的是( )
| A. | c=$\frac{3b}{0.0224V}$ | B. | e=a+$\frac{8cV}{1000}$ | C. | d=a+$\frac{17cV}{1000}$ | D. | $\frac{82a}{65}$<e<$\frac{5a}{4}$ |
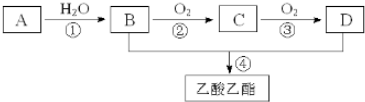
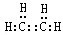 .
.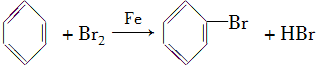 ,取代反应.
,取代反应.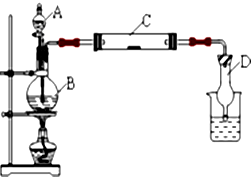 为了探究氯气和氯水的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中,试回答:
为了探究氯气和氯水的一些化学性质,某学生用如图所示装置进行有关实验,打开A的玻璃塞,将A中浓盐酸溶液逐滴加入装有二氧化锰的B中,试回答: