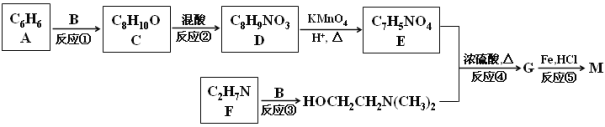
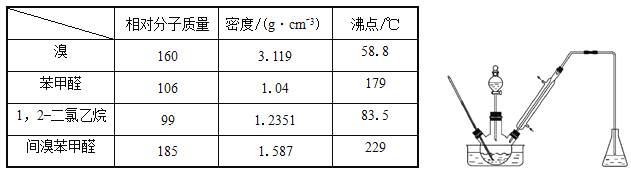
题目内容
【题目】地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。某课题组模拟地下水脱氮过程,利用如下装置探究Fe粉和KNO3溶液反应及相关因素对脱氮速率的影响。
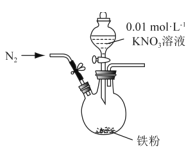
实验过程如下:
Ⅰ.原料预处理:①先用0.1mol·L-1H2SO4洗涤Fe粉,然后用蒸馏水洗涤至中性;②将0.01mol/L KNO3溶液的pH调至2.5;③打开弹簧夹,缓慢通入N2,并保持后续反应均在N2氛围中进行;
Ⅱ.加入KNO3酸性溶液100mL,一段时间后铁粉部分溶解,溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现,剩余固体表面有少量白色物质附着;
Ⅲ.过滤剩余固体时,表面的白色物质变为红褐色;
Ⅳ.检测到滤液中存在NO3-、NH4+、Fe2+。
(1)步骤Ⅰ中用0.1mol L-1H2SO4洗涤Fe粉的目的是 ,通入N2并保持后续反应均在N2氛围中进行的目的是 。
(2)白色物质是 ,用化学方程式解释其变为红褐色的原因: 。
(3)用K3[Fe(CN)6]检验滤液中Fe2+ 的实验方案是 。
(4)取少量滤液,向其中加入几滴KSCN溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色。溶液变成红色的原因是 。
(5)该课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三:
①假设一:溶液的pH;假设二:____________________;假设二:____________________;
②设计实验验证上述假设一,请完善实验步骤及结论。(已知:溶液中的NO3-浓度可用离子色谱仪测定)
实验步骤:
ⅰ.分别取 的KNO3溶液于不同的试管中;
ⅱ.调节溶液呈酸性且pH各不相同,并通入N2;
ⅲ.分别向上述溶液中加入足量等质量的同种铁粉;
ⅳ.用离子色谱仪测定相同时间内各溶液中NO3-浓度。
实验结论: 。
【答案】
(1)除去铁粉表面的氧化物等杂质(1分)
避免空气中的氧气对铁和硝酸根离子的反应产生干扰(1分)
(2)Fe(OH)2(1分) 4Fe(OH)2+O2+2H2O=4Fe(OH)3(2分)
(3)取滤液,向其中滴加几滴K3[Fe(CN)6],若观察到蓝色沉淀,则证明滤液中存在二价铁离子(2分)
(4)溶液中存在二价铁离子和硝酸根离子,加入氢离子后,发生反应3Fe2++NO3-+4H+=3Fe3++ NO↑+2H2O。生成的三价铁离子与SCN-反应使溶液变红(2分)
(5)①温度(1分) 铁粉颗粒大小(1分)
②等体积、等浓度(1分)
若pH不同的KNO3溶液中,测出的NO3-浓度不同,表明pH对脱氮速率有影响,否则无影响
(1分)
【解析】
试题分析:
(1)H2SO4能够与金属氧化物反应,用0.1mol·L-1H2SO4洗涤Fe粉的目的是去除铁粉表面的氧化物等杂质;为了避免空气中的氧气对铁和硝酸根离子的反应产生干扰,需要通入N2并保持后续反应均在N2氛围中进行,故答案为:去除铁粉表面的氧化物等杂质;避免空气中的氧气对铁和硝酸根离子的反应产生干扰。
(2)根据实验现象:一段时间后铁粉部分溶解,溶液逐渐变为浅绿色,白色物质是Fe(OH)2;Fe(OH)2在空气中容易被氧化为氢氧化铁,化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:Fe(OH)2;4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)检验滤液中Fe2+ 的实验步骤为取滤液,向其中滴加几滴K3[Fe(CN)6],若观察到蓝色沉淀,则证明滤液中存在二价铁离子,故答案为:取滤液,向其中滴加几滴K3[Fe(CN)6],若观察到蓝色沉淀,则证明滤液中存在二价铁离子。
(4)取少量滤液,向其中加入几滴KSCN溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色是因为溶液中存在二价铁离子和硝酸根离子,加入氢离子后,发生反应3Fe2++NO3-+4H+=3Fe3++ NO↑ +2H2O。生成的三价铁离子与SCN-反应使溶液变红,故答案为:溶液中存在二价铁离子和硝酸根离子,加入氢离子后,发生反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O。生成的三价铁离子与SCN-反应使溶液变红。
(5)根据影响化学反应速率的因素分析,①假设一:溶液的pH;假设二:温度;假设二:铁粉颗粒大小,故答案为:温度;铁粉颗粒大小;②根据影响化学反应速率的因素,实验设计时需要保证只有一个因素不同,其他因素相同来设计, 实验步骤中ⅰ.分别取等体积、等浓度的KNO3溶液于不同的试管中;根据步骤ⅱ可知,若pH不同的KNO3溶液中,测出的NO3-浓度不同,表明pH对脱氮速率有影响,否则无影响,故答案为:等体积、等浓度;若pH不同的KNO3溶液中,测出的NO3-浓度不同,表明pH对脱氮速率有影响,否则无影响。

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案