题目内容
【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程:
。
(2)联氨(N2H4)是一种还原剂。已知:H2O(l)=H2O(g) △H=+44kJ/mol。试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式: 。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)KCN可用于溶解难溶金属卤化物。将AgI溶于KCN溶液中,形成稳定的Ag(CN)2—,该转化的离子方程式为: 。若已知Ksp(AgI)=1.5×10—16,K稳[Ag(CN)2—]=1.0×10-21,则上述转化方程式的平衡常数K= 。(提示:K稳越大,表示该化合物越稳定)
(4)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式: 。
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]()
![]() N2O4其相关图像如下。
N2O4其相关图像如下。

①0~3s时v(NO2)增大的原因是 。
②5s时NO2转化率为 。
【答案】(1)![]()
(2)N2H4 (g)+O2(g)=N2(g)+2H2O(l) △H=—631.7kJ/mol
(3)AgI(s)+2CN—(aq)![]() Ag(CN)2—(aq)+I—(aq); 1.5×105(4)NH3—5e—+5OH—=NO+4H2O(5)容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大 ;75%
Ag(CN)2—(aq)+I—(aq); 1.5×105(4)NH3—5e—+5OH—=NO+4H2O(5)容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大 ;75%
【解析】
试题分析:(1)用电子式表示氮气的形成过程:![]() ,故答案为:
,故答案为:![]() ;
;
(2)△H等于反应物的键能之和-生成物的键能之和,N2H4 (g)燃烧热的热化学方程式为N2H4 (g)+O2(g)=N2(g)+2H2O(l) △H=(390.8×4+193+497.3)-(946+462.8×4)-44×2=—631.7kJ/mol,故答案为:N2H4 (g)+O2(g)=N2(g)+2H2O(l) △H=—631.7kJ/mol
(3)KCN可用于溶解难溶金属卤化物。将AgI溶于KCN溶液中,形成稳定的Ag(CN)2—,该转化的离子方程式为AgI(s)+2CN—(aq)![]() Ag(CN)2—(aq)+I—(aq);则上述转化方程式的平衡常数K=
Ag(CN)2—(aq)+I—(aq);则上述转化方程式的平衡常数K=![]() =
=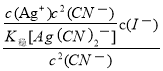 =
=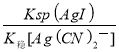 =1.5×105,故答案为:AgI(s)+2CN—(aq)
=1.5×105,故答案为:AgI(s)+2CN—(aq)![]() Ag(CN)2—(aq)+I—(aq);1.5×105
Ag(CN)2—(aq)+I—(aq);1.5×105
(4)氨的催化氧化的方程式为4NH3+5O2═4NO+6H2O,该反应设计成新型电池,在碱性环境下,该电池的负极上氨气失去电子生成一氧化氮气体,电极反应式为NH3—5e—+5OH—=NO+4H2O,故答案为:NH3—5e—+5OH—=NO+4H2O;
(5)①依据反应是放热反应,在绝热恒容容器中,反应进行热量升高,反应速率增大,随反应进行二氧化氮浓度减小,反应为达到平衡,0-3s时v(NO2)增大是由于体系温度升高,故答案为:容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大;
②分析图象5s二氧化氮变化浓度=2mol/L-0.5mol/L=1.5mol/L,结合转化率概念计算=![]() ×100%=
×100%=![]() ×100%=75%,故答案为:75%;
×100%=75%,故答案为:75%;

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案