题目内容
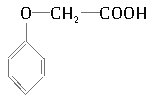
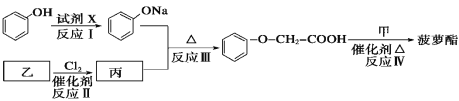
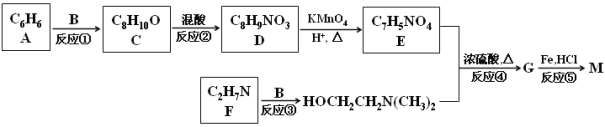
【题目】普鲁卡因M [结构简式为![]() ]可用作临床麻醉剂,熔点约为60 ℃。它的一条合成路线如下图所示(部分反应试剂和条件已省略):
]可用作临床麻醉剂,熔点约为60 ℃。它的一条合成路线如下图所示(部分反应试剂和条件已省略):
已知:Ⅰ.B和乙醛互为同分异构体,![]() 的结构不稳定;
的结构不稳定;
Ⅱ. ![]() ;
;
Ⅲ. ![]() 。
。
请回答下列问题:
(1)E所含官能团的名称是 ;B的结构简式的 。
(2)比A多两个碳原子,且一氯代物只有3种的A的同系物的名称是 。
(3)下列说法正确的是 。
A.M分子中含有碱性基团氨基,能与盐酸发生反应,临床上常用M的盐酸盐作麻醉剂
B.题中的“混酸”是将浓硫酸缓慢加入浓硝酸中并不断搅拌而得的混合物
C.①、③属于加反应;②、④、⑤属于取代反应
D.反应①原子利用率达100%,生成的C通过加聚反应可直接生成高聚物聚苯乙烯,是一种绿色环保的工艺流程
(4)写出反应④的化学方程式 。
(5)写出一种同时满足下列条件的D的同分异构体的结构简式 。
①能与碳酸氢钠溶液反应 ②含有—NH2 ③苯环上有2种不同环境的氢原子
【答案】
(1)羧基、硝基(2分) ![]() (1分)
(1分)
(2)邻二甲苯(或1,2二甲苯) (1分)
(3)AB (2分)
(4)![]() (2分)
(2分)
(5)![]() (2分,其它合理答案也给分)
(2分,其它合理答案也给分)
【解析】
试题分析:普鲁卡因分子中有苯环结构,A的分子式为C6H6,所以A为苯;B为乙醛的同分异构体,但CH2=CHOH不稳定,则B只能为环氧乙烷![]() ;从A、B、C的分子式分析,C的分子式为A与B的分子式之和,则反应①为苯的取代反应,产物C为C6H5CH2CH2OH;反应②为苯的硝化反应,根据普鲁卡因的结构可知,D的苯环上两取代基处于对位,其结构简式为:
;从A、B、C的分子式分析,C的分子式为A与B的分子式之和,则反应①为苯的取代反应,产物C为C6H5CH2CH2OH;反应②为苯的硝化反应,根据普鲁卡因的结构可知,D的苯环上两取代基处于对位,其结构简式为:![]() ;D被酸性高锰酸钾氧化生成产物E为对硝基苯甲酸:
;D被酸性高锰酸钾氧化生成产物E为对硝基苯甲酸:![]() ;比较反应③的反应物与产物的结构可知F为(CH3)2NH,反应为取代反应;反应④为酯化反应(取代反应),产物G为
;比较反应③的反应物与产物的结构可知F为(CH3)2NH,反应为取代反应;反应④为酯化反应(取代反应),产物G为![]() ;反应⑤为G的还原反应,得产物普鲁卡因M。
;反应⑤为G的还原反应,得产物普鲁卡因M。
(1)从上述分析可知,E为对硝基苯甲酸:![]() ,所含官能团的羧基、硝基;B的结构简式为
,所含官能团的羧基、硝基;B的结构简式为![]() 。
。
(2)比A多两个碳原子的A的同系物,分子式为C8H10,其一氯代物有3种,则该物质为邻二甲苯(或1,2二甲苯)(注意:3种取代产物分别是苯环上取代物2种、甲基上取代物1种)。
(3)A.M分子中的—NH2为碱性基团,能与盐酸发生反应,临床上常用盐酸普鲁卡困作麻醉剂,故A正确;B.“混酸”为浓硫酸与浓硝酸的混合物,由于常用浓硫酸浓度大(约98%),密度大,浓度硝酸浓度相对较小(约69%),密度相对较小,两酸混合时会产生大量的热,所以两酸混合时的操作是将浓硫酸缓慢加入浓硝酸中并不断搅拌,使产物的热量迅速的扩散,故B正确;C.①、②、③、④属于取代反应(有种观点认为反应①和②对于环乙烷来说属于开环加成,这或许是广义的加成反应,但不符合中学化学课本加成反应的定义),⑤属于还原反应(既有“加氢”又有“去氧”),故C不正确;D.C的结构简式为C6H5CH2CH2OH,由C制取聚苯乙烯,需经过消去反应生成苯乙烯,再经加聚反应才能制得,故D不正确。
(4)E为含有羧基,可与![]() 发生酯化反应,反应的化学方程式为:
发生酯化反应,反应的化学方程式为: ![]()
(5)能与碳酸氢钠溶液反应说明结构中有羧基,苯环上有2种不同环境的氢原子,说明苯环上应有两个不同的取代基且处于对位,而D的分子式为C8H9NO3,分子结构中含有—NH2,综合考虑,符合条件的D的同分异构体的结构简式可以写出多种,如 ![]() 、
、![]() 、
、![]() 、
、![]() 。
。

 名校课堂系列答案
名校课堂系列答案