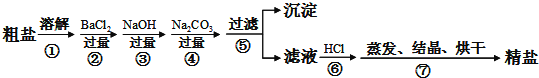
题目内容
【题目】废旧锂离子电池正极材料的主要成分为碳棒和![]() ,另含少量
,另含少量![]() 、
、![]() 杂质。某厂按如图流程对废旧锂离子电池的正极进行回收再生。回答有关问题:
杂质。某厂按如图流程对废旧锂离子电池的正极进行回收再生。回答有关问题:
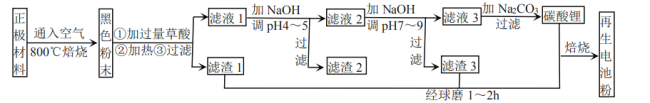
已知:①草酸电离常数:![]() ,
,![]() ;草酸的酸式盐以及草酸锂均可溶。
;草酸的酸式盐以及草酸锂均可溶。
②常温时,有关物质Ksp如下表(单位略):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)通入空气,800℃焙烧目的是___________________________。
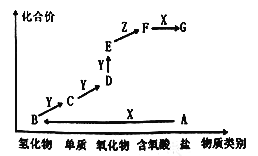
(2)已知![]() 中
中![]() 、
、![]() 、
、![]() 化合价相同,则它们的化合价为_________。
化合价相同,则它们的化合价为_________。
(3)加入草酸加热时,![]() 、
、![]() 、
、![]() 元素部分转化为
元素部分转化为![]() 、
、![]() 、
、![]() 沉淀,而另一部分以草酸的酸式盐形式进入溶液。写出
沉淀,而另一部分以草酸的酸式盐形式进入溶液。写出![]() 与草酸反应生成
与草酸反应生成![]() 沉淀的化学方程式_________。
沉淀的化学方程式_________。
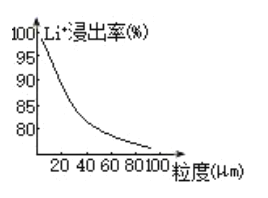
(4)焙烧后黑色粉的平均粒度(颗粒直径表示)与![]() 的浸出率关系如图所示,原因是___________。
的浸出率关系如图所示,原因是___________。
(5)滤液1加![]() 调pH为4~5目的是_____________________。
调pH为4~5目的是_____________________。
(6)滤液2调![]() 时,溶液中
时,溶液中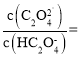 ___________。
___________。
【答案】除去正极材料中的碳 +3 ![]() 粒度越大,表面积(比表面积)越小,反应物接触面积就越小,反应速率越慢,且反应不充分 使
粒度越大,表面积(比表面积)越小,反应物接触面积就越小,反应速率越慢,且反应不充分 使![]() 和
和![]() 转化为氢氧化物沉淀除去
转化为氢氧化物沉淀除去 ![]()
【解析】
废旧锂离子电池正极材料的主要成分为碳棒和![]() ,另含少量
,另含少量![]() 、
、![]() 杂质,经800℃焙烧,将碳转化为二氧化碳;加入草酸加热时,
杂质,经800℃焙烧,将碳转化为二氧化碳;加入草酸加热时,![]() 、
、![]() 、
、![]() 元素部分转化为
元素部分转化为![]() 、
、![]() 、
、![]() 沉淀,而另一部分以草酸的酸式盐形式进入溶液;加入氢氧化钠调节pH除去三价铁,三价铝,再加碳酸钠沉淀Li+;最终焙烧,得可再生电池粉。
沉淀,而另一部分以草酸的酸式盐形式进入溶液;加入氢氧化钠调节pH除去三价铁,三价铝,再加碳酸钠沉淀Li+;最终焙烧,得可再生电池粉。
(1)经分析,通入空气,800℃焙烧目的是将正极材料中的碳转化为二氧化碳而除去,故答案为:除去正极材料中的碳;
(2) ![]() 中
中![]() 、
、![]() 、
、![]() 化合价相同,设为a,Li的化合价为+1,O为-2价,根据正负化合价的代数和为零,得
化合价相同,设为a,Li的化合价为+1,O为-2价,根据正负化合价的代数和为零,得![]() ,a=3,故答案为:+3;
,a=3,故答案为:+3;
(3) ![]() 与草酸反应生成
与草酸反应生成![]() 、
、![]() ,同时Co的化合价从+3变为+2,C的化合价要升高,从+3变为+4,生成CO2,故答案为:
,同时Co的化合价从+3变为+2,C的化合价要升高,从+3变为+4,生成CO2,故答案为:![]() ;
;
(4)由图分析以及接触面积与化学反应速率的关系,可知,粒度越大,表面积(比表面积)越小,反应物接触面积就越小,反应速率越慢,且反应不充分,故答案为:粒度越大,表面积(比表面积)越小,反应物接触面积就越小,反应速率越慢,且反应不充分;
(5). 通过氢氧化铁的电离方程式和溶度积可算出Fe3+离子浓度为10-5mol/L时,OH-的浓度为2×10-11![]() 和
和![]() 转化为氢氧化物沉淀除去;
转化为氢氧化物沉淀除去;
(6) 溶液中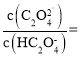
 ,故答案为:
,故答案为:![]() 。
。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案