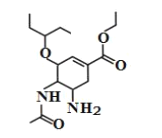
题目内容
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质.以下是制备精盐的实验方案,各步操作流程如下:
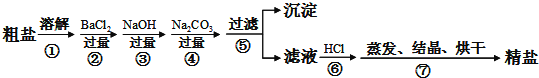
(1)第②步操作的目的是除去粗盐中的______(填化学式)。
(2)第⑤步“过滤”操作中得到沉淀的成分有:泥沙、BaSO4、Mg(OH)2、CaCO3、___(填化学式)。
(3)在第③步操作中,选择的除杂试剂不能用KOH代替NaOH,理由是________。
(4)写出第⑥步反应的离子方程式_______________,______________。
【答案】Na2SO4 BaCO3 会引入K+杂质 OH-+H+=H2O CO32-+2H+=CO2↑+ H2O
【解析】
粗盐除杂时,应先用氯化钡除去硫酸根离子,用NaOH除去镁离子,再用碳酸钠除去钙离子、钡离子,可减少操作步骤;过滤除去沉淀,加入HCl除去过量的碳酸钠、NaOH,得到NaCl溶液,蒸发、结晶、烘干得到精盐。
(1)第②步操作可除去溶液中的硫酸根离子,即Na2SO4;
(2)第④时,既可除去溶液中的氯化钙,又可除去②步加入稍过量的BaCl2,则⑤步“过滤”操作沉淀的成分有:泥沙、BaSO4、Mg(OH)2、CaCO3、BaCO3;
(3)在第③步操作中,用KOH代替NaOH时会产生K+杂质;
(4)第⑥步反应除去除杂过程中加入稍过量NaOH、Na2CO3,则反应的离子方程式为OH-+H+=H2O,CO32-+2H+=CO2↑+ H2O。

 新题型全程检测期末冲刺100分系列答案
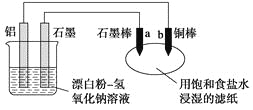
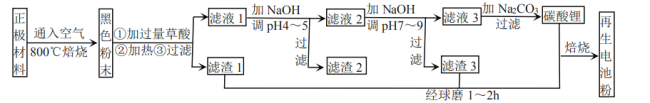
新题型全程检测期末冲刺100分系列答案【题目】废旧锂离子电池正极材料的主要成分为碳棒和![]() ,另含少量
,另含少量![]() 、
、![]() 杂质。某厂按如图流程对废旧锂离子电池的正极进行回收再生。回答有关问题:
杂质。某厂按如图流程对废旧锂离子电池的正极进行回收再生。回答有关问题:
已知:①草酸电离常数:![]() ,
,![]() ;草酸的酸式盐以及草酸锂均可溶。
;草酸的酸式盐以及草酸锂均可溶。
②常温时,有关物质Ksp如下表(单位略):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)通入空气,800℃焙烧目的是___________________________。
(2)已知![]() 中
中![]() 、
、![]() 、
、![]() 化合价相同,则它们的化合价为_________。
化合价相同,则它们的化合价为_________。
(3)加入草酸加热时,![]() 、
、![]() 、
、![]() 元素部分转化为
元素部分转化为![]() 、
、![]() 、
、![]() 沉淀,而另一部分以草酸的酸式盐形式进入溶液。写出
沉淀,而另一部分以草酸的酸式盐形式进入溶液。写出![]() 与草酸反应生成
与草酸反应生成![]() 沉淀的化学方程式_________。
沉淀的化学方程式_________。
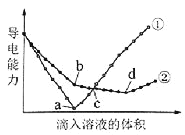
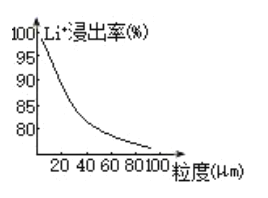
(4)焙烧后黑色粉的平均粒度(颗粒直径表示)与![]() 的浸出率关系如图所示,原因是___________。
的浸出率关系如图所示,原因是___________。
(5)滤液1加![]() 调pH为4~5目的是_____________________。
调pH为4~5目的是_____________________。
(6)滤液2调![]() 时,溶液中
时,溶液中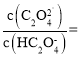 ___________。
___________。