题目内容
【题目】CO和CO2是碳的两种氧化物,请计算:
(1)在标准状况下,5.6LCO的物质的量是__________,质量是__________。
(2)11gCO2在标准状况下的体积是__________。
(3)相同物质的量的CO和CO2所含氧原子个数之比为__________。
【答案】0.25mol 7g 5.6L 1:2
【解析】
(1)根据n=![]() 计算气体的物质的量,结合m=nM计算气体的质量;
计算气体的物质的量,结合m=nM计算气体的质量;
(2)先根据m=nM计算气体的物质的量,然后根据n=![]() 计算气体的物质的量;
计算气体的物质的量;
(3)根据n=![]() 及物质分子中含有的氧原子个数计算。
及物质分子中含有的氧原子个数计算。
(1)在标准状况下,5.6LCO的物质的量n(CO)=5.6L÷22.4L/mol=0.25mol,其质量m(CO)=n·M=0.25mol×28g/mol=7g;
(2)11gCO2气体的物质的量n(CO2)=11g÷44g/mol=0.25mol,该气体在标准状况下的体积V(CO2)=0.25mol×22.4L/mol=5.6L;
(3)由n=![]() 可知:气体的物质的量的比等于气体分子数的比。由于CO、CO2分子中分别含有1个、2个O原子,所以相同物质的量的CO和CO2所含氧原子个数之比为1:2。
可知:气体的物质的量的比等于气体分子数的比。由于CO、CO2分子中分别含有1个、2个O原子,所以相同物质的量的CO和CO2所含氧原子个数之比为1:2。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】废旧锂离子电池正极材料的主要成分为碳棒和![]() ,另含少量
,另含少量![]() 、
、![]() 杂质。某厂按如图流程对废旧锂离子电池的正极进行回收再生。回答有关问题:
杂质。某厂按如图流程对废旧锂离子电池的正极进行回收再生。回答有关问题:
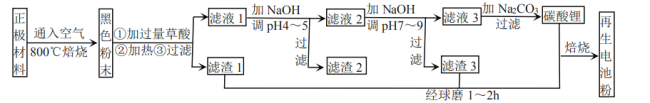
已知:①草酸电离常数:![]() ,
,![]() ;草酸的酸式盐以及草酸锂均可溶。
;草酸的酸式盐以及草酸锂均可溶。
②常温时,有关物质Ksp如下表(单位略):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)通入空气,800℃焙烧目的是___________________________。
(2)已知![]() 中
中![]() 、
、![]() 、
、![]() 化合价相同,则它们的化合价为_________。
化合价相同,则它们的化合价为_________。
(3)加入草酸加热时,![]() 、
、![]() 、
、![]() 元素部分转化为
元素部分转化为![]() 、
、![]() 、
、![]() 沉淀,而另一部分以草酸的酸式盐形式进入溶液。写出
沉淀,而另一部分以草酸的酸式盐形式进入溶液。写出![]() 与草酸反应生成
与草酸反应生成![]() 沉淀的化学方程式_________。
沉淀的化学方程式_________。
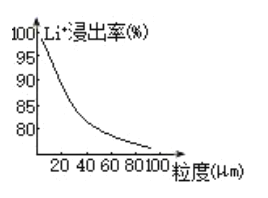
(4)焙烧后黑色粉的平均粒度(颗粒直径表示)与![]() 的浸出率关系如图所示,原因是___________。
的浸出率关系如图所示,原因是___________。
(5)滤液1加![]() 调pH为4~5目的是_____________________。
调pH为4~5目的是_____________________。
(6)滤液2调![]() 时,溶液中
时,溶液中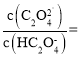 ___________。
___________。