题目内容
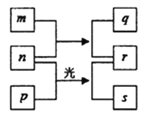
【题目】如图所涉及的物质均为中学化学中的常见物质,其中C和D为气体单质,F是一种有磁性的黑色固体。它们存在如下转化关系,反应中生成的水及次要产物均已略去。

(1)写出有关物质的化学式:A______________,H______________。
(2)指出MnO2在相关反应中的作用:反应①中是___________剂,反应②中是________剂。
(3)写出B与MnO2共热获得D的化学方程式:___________________________________。
【答案】 H2O2 FeCl3 催化 氧化 MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
【解析】中学阶段与MnO2反应的制备的气体有O2和Cl2,其中在不加热条件下,用H2O2和MnO2制备O2,在加热条件下用氯酸钾在加热条件分解制氧气,用浓盐酸和MnO2制备Cl2,则A为H2O2,B为HCl,C为O2,D为Cl2,F为金属氧化物,有磁性,与盐酸反应生成两种氯化物,且二者之间可以相互转化,说明E为变价金属,应为Fe,是目前人类应用最广泛的金属,则F为Fe3O4,G为FeCl2,H为FeCl3。
(1)由以上分析可知,A为 H2O2,H为FeCl3;正确答案:H2O2;FeCl3。
(2)在不加热条件下,用H2O2和MnO2制备O2,H2O2起到催化剂的作用,在加热条件下用浓盐酸和MnO2制备Cl2,发生:4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O,MnO2起到氧化剂的作用;正确答案:催化;氧化。
MnCl2+Cl2↑+2H2O,MnO2起到氧化剂的作用;正确答案:催化;氧化。
(3)反应②是在加热条件下进行,判断为实验室制氯气的反应,反应的化学方程式:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑;正确答案:MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑;正确答案:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑。
MnCl2+2H2O+Cl2↑。

【题目】用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品.将样品配成250mL待测液,需要的仪器除了小烧杯、玻璃棒、量筒还需要 .
(2)取10.00mL待测液,用量取.
(3)用0.2010molL﹣1标准盐酸滴定待测烧碱溶液,甲基橙做指示剂,滴定时左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视的现象时即到达滴定终点.
(4)根据下列数据,计算待测烧碱溶液的纯度: . (保留四位有效数字)
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 0.10 | 22.10 |
第三次 | 10.00 | 4.00 | 24.10 |
(5)以下操作会造成测量结果偏高的是 ①用蒸馏水冲洗锥形瓶;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外;
③读数时,滴定前仰视,滴定后俯视;
④装标准液之前,没有用标准液润洗滴定管.