题目内容
【题目】下列描述中正确的是( )
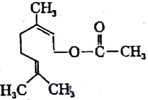
A.CS2为V形的极性分子
B.ClO3﹣的空间构型为平面三角形
C.SiF4和SO32﹣的中心原子均为sp2杂化
D.SF6中有6对相同的成键电子对
【答案】D
【解析】解:A.CS2与CO2分子构型相同,二氧化碳的分子结构为O=C=O,则CS2的结构为S=C=S,CS2含有C=S极性键,分子为线型结构,结构对称,正负电荷的中心重合,为非极性分子,故A错误; B.ClO3﹣中Cl的价层电子对数=3+ ![]() (7+1﹣2×3)=4,含有一个孤电子对,则离子的空间构型为三角锥形,故B错误;
(7+1﹣2×3)=4,含有一个孤电子对,则离子的空间构型为三角锥形,故B错误;
C.SiF4中Si的价层电子对数=4+ ![]() (4﹣1×4)=4,SO32﹣中S的价层电子对数=3+
(4﹣1×4)=4,SO32﹣中S的价层电子对数=3+ ![]() (6+2﹣2×3)=4,所以中心原子均为sp3杂化,故C错误;
(6+2﹣2×3)=4,所以中心原子均为sp3杂化,故C错误;
D.SF6中S﹣F含有一个成键电子对,硫原子最外层有6个电子,和氟原子之间有6对完全相同的成键电子对,所以SF6中含有6个S﹣F键,则分子中有6对完全相同的成键电子对,故D正确;
故选D.

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
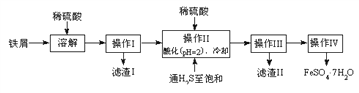
查询资料,得有关物质的数据如下表:
25℃时 | 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 |
pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为____________________。
A.KSCN溶液B.NaOH溶液C.KMnO4溶液
(2)操作II中,通入硫化氢至饱和的目的是(写两点)___________、____________。
(3)操作IV的顺序依次为________、冷却结晶、过滤。
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取3.72g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时盛放KMnO4溶液的仪器为_________(填仪器名称)。
②计算上述样品中FeSO47H2O的质量分数为__________。
③上述测定中,若滴定管规格为50mL,则步骤a中称取样品的质量不能超过______g。(保留4位小数)
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定
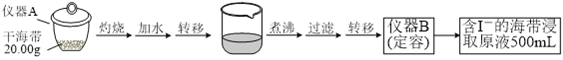
取0.0100 mol·Lˉ1的AgNO3标准溶液装入滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
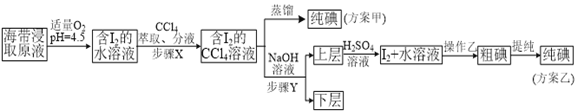
已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
请回答:
(1)实验(一) 中的仪器名称:仪器A_________, 仪器 B___________________。
(2)该次滴定终点时用去AgNO3溶液的体积为20.00mL,计算得海带中碘的百分含量为_______%。
(3)①分液漏斗使用前须检漏,检漏方法为___________________。
②步骤X中,萃取后分液漏斗内观察到的现象是_______________。
③下列有关步骤Y的说法,正确的是___________________。
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是______________________。
(4)方案甲中采用蒸馏不合理,理由是_____________________。