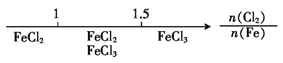
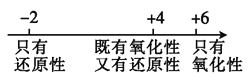
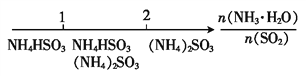题目内容
【题目】对H2O的电离平衡不产生影响的粒子是( )
A.![]()
B.![]() Fe3+
Fe3+
C.
D.
【答案】C
【解析】解:A.HCl在水溶液中电离出氢离子而抑制水电离,故A错误; B.铁离子属于弱碱阳离子,铁离子水解而促进水电离,故B错误;
C.该离子是氯离子,属于强酸根离子,不水解而不影响水电离,故C正确;
D.乙酸是弱酸,乙酸根离子属于弱离子,因为水解而促进水电离,故D错误;
故选C.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

 名校课堂系列答案
名校课堂系列答案【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定
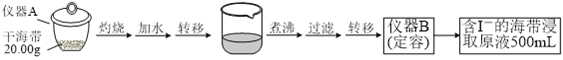
取0.0100 mol·Lˉ1的AgNO3标准溶液装入滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
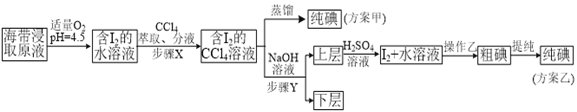
已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
请回答:
(1)实验(一) 中的仪器名称:仪器A_________, 仪器 B___________________。
(2)该次滴定终点时用去AgNO3溶液的体积为20.00mL,计算得海带中碘的百分含量为_______%。
(3)①分液漏斗使用前须检漏,检漏方法为___________________。
②步骤X中,萃取后分液漏斗内观察到的现象是_______________。
③下列有关步骤Y的说法,正确的是___________________。
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是______________________。
(4)方案甲中采用蒸馏不合理,理由是_____________________。