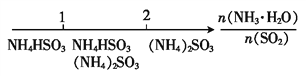题目内容
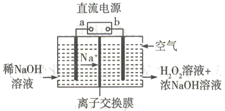
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、n、s是由这些元素组成的二元化合物。p和r分别是元素Z和X的单质,p通常为黄绿色气体。常温下0.01mol·L-1q的水溶液的pH为12。上述物质的转化关系如图所示。下列说法正确的是
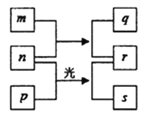
A. 离子半径的大小Z>Y>X B. 单质的还原性:Y>W
C. W在化合物中一定是+1价 D. Z的氧化物的水化物为强酸
【答案】B
【解析】p为黄绿色气体,则p是Cl2;p是元素Z的单质,则Z是Cl元素;常温下0.01mol·L-1q的水溶液pH为12,则q为一元强碱,短周期元素中能形成强碱的金属阳离子只有Na+,故q为NaOH,含有Na、O、H三种元素;W、X、Y的原子序数依次增加,所以W为H元素,X为O元素,Y为Na元素;r是X的单质,所以r为O2。
A、元素X、Y、Z形成的离子分别为:O2-、Na+、Cl-,O2-与Na+核外电子排布相同,均有2个电子层,Cl-有3个电子层。电子层数越大,半径越大,Cl-半径最大;电子层数相同时,核电荷数越大半径越小,所以半径O2->Na+,所以三者离子半径大小顺序为Cl->O2->Na+,即Z>X>Y,故A错误;B、Y的单质为Na,而W的单质为H2,Na能在水中置换出H2,故Na的还原性强于H2,即Y>W,故B正确;C、W(H)常见的价态为+1价,NaH中H为-1价,故C错误;D、元素Z(Cl)的非金属性很强,其最高价氧化物的水化物HClO4为最强酸,但Cl的其他价态的氧化物的水化物酸性不一定强,比如HClO为弱酸,故D错误。选B。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
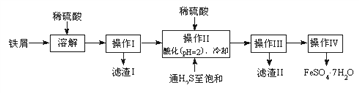
查询资料,得有关物质的数据如下表:
25℃时 | 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 |
pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为____________________。
A.KSCN溶液B.NaOH溶液C.KMnO4溶液
(2)操作II中,通入硫化氢至饱和的目的是(写两点)___________、____________。
(3)操作IV的顺序依次为________、冷却结晶、过滤。
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取3.72g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时盛放KMnO4溶液的仪器为_________(填仪器名称)。
②计算上述样品中FeSO47H2O的质量分数为__________。
③上述测定中,若滴定管规格为50mL,则步骤a中称取样品的质量不能超过______g。(保留4位小数)