题目内容
【题目】加热N2O5,依次发生的分解反应为:①N2O5(g)![]() N2O3(g)+O2(g),②N2O3(g)
N2O3(g)+O2(g),②N2O3(g)![]() N2O(g)+O2(g)。在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol,则t℃时反应①的平衡常数为( )
N2O(g)+O2(g)。在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol,则t℃时反应①的平衡常数为( )
A. 4.25 B. 8.5 C. 17 D. 22.5
【答案】B
【解析】在反应①中N2O3与O2 按物质的量之比1∶1生成,如果不发生反应②,则两者一样多。发生反应②,平衡后,O2比N2O3多(9-3.4)=5.6mol;反应②中每减少1mol N2O3,O2会增加1mol,即O2会比N2O3多2mol;O2比N2O3多(9-3.4)=5.6mol,则共分解了2.8mol N2O3;所以反应①中N2O5分解生成N2O3(3.4+2.8)=6.2mol,有6.2mol N2O5发生分解,所以平衡后N2O5为(8-6.2)=1.8mol。容器体积为2L,则反应①的平衡常数K=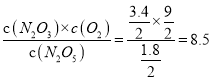 ,故选B。
,故选B。

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目