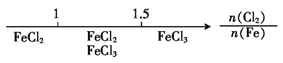
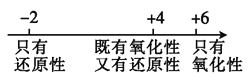
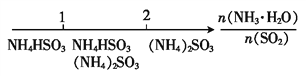题目内容
【题目】用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品.将样品配成250mL待测液,需要的仪器除了小烧杯、玻璃棒、量筒还需要 .
(2)取10.00mL待测液,用量取.
(3)用0.2010molL﹣1标准盐酸滴定待测烧碱溶液,甲基橙做指示剂,滴定时左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视的现象时即到达滴定终点.
(4)根据下列数据,计算待测烧碱溶液的纯度: . (保留四位有效数字)
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 0.10 | 22.10 |
第三次 | 10.00 | 4.00 | 24.10 |
(5)以下操作会造成测量结果偏高的是 ①用蒸馏水冲洗锥形瓶;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外;
③读数时,滴定前仰视,滴定后俯视;
④装标准液之前,没有用标准液润洗滴定管.
【答案】
(1)250 mL容量瓶、胶头滴管
(2)碱式滴定管
(3)锥形瓶中溶液颜色的变化;溶液由黄色变为橙色,且半分钟内不恢复
(4)98.05%
(5)②④
【解析】解:(1)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器是:托盘天平、药匙、烧杯、玻璃棒、250mL容量瓶、胶头滴管,需要的仪器除了小烧杯、玻璃棒、量筒还需要250 mL容量瓶、胶头滴管, 所以答案是:250 mL容量瓶、胶头滴管;(2)待测液是碱性溶液,取10.00mL待测液,用碱式滴定管量取,
所以答案是:碱式滴定管;(3)滴定时,两眼注视锥形瓶中溶液颜色的变化,以便准确判断终点的到达;用0.2010molL﹣1标准盐酸滴定待测烧碱溶液,甲基橙做指示剂溶液呈黄色,滴入盐酸反应终点变化为橙色且半分钟内不恢复,说明反应达到终点,
所以答案是:锥形瓶中溶液颜色的变化;溶液由黄色变为橙色,且半分钟内不恢复;(4)图表中第一次消耗标准溶液体积=20.40ml﹣0.50ml=19.90ml,第二次消耗溶液体积=22.10ml﹣0.10ml=22.00ml,误差较大舍去,第三次消耗溶液体积=20.40ml﹣040ml=20.00ml,标准溶液平均消耗体积= ![]() =19.95ml,待测液溶液浓度c=
=19.95ml,待测液溶液浓度c= ![]() =0.4010mol/L,
=0.4010mol/L,
待测烧碱溶液的纯度= ![]() ×100%=98.05%,
×100%=98.05%,
所以答案是:98.05%;(5)①用蒸馏水冲洗锥形瓶,对测定结果无影响,故①错误;②在滴定过程中不慎将数滴酸液滴在锥形瓶外,消耗标准溶液体积增大,测定浓度偏大,故②正确;③读数时,滴定前仰视,滴定后俯视,读取标准溶液体积减小,测定浓度偏小,故③错误;④装标准液之前,没有用标准液润洗滴定管,消耗标准溶液体积增大,测定浓度偏大,故④正确;
所以答案是:②④.
【考点精析】通过灵活运用酸碱中和滴定,掌握中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点即可以解答此题.

 阅读快车系列答案
阅读快车系列答案【题目】I、三氧化二镍(Ni2O3)是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料生产NiCl2,继而生产Ni2O3的工艺流程如下:

下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |
(1)①为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有:适当升高温度,搅拌,______等。
②酸浸后的酸性溶液中含有Ni2+、Cl-,另含有少量Fe2+、Fe3+、Al3+等。在沉镍前,需加Na2CO3控制溶液pH范围为______。
(2)“氧化”生成Ni2O3的离子方程式为______。
(3)工业上用镍为阳极,电解0.05 ~ 0.1 mol·L-1 NiCl2 溶液与一定量NH4Cl组成的混合溶液,可得到高纯度、球形的超细镍粉。当其它条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如下图所示,则NH4Cl的浓度最好控制为______。

II、煤制天然气的工艺流程简图如下:

(4)已知反应I:C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:______。
CO(g)+H2(g) ΔH=+135 kJ·mol-1,通入的氧气会与部分碳发生燃烧反应。请利用能量转化及平衡移动原理说明通入氧气的作用:______。
(5)①甲烷化反应IV发生之前需要进行脱酸反应III。煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和_____。
②工业上常用热碳酸钾溶液脱除H2S气体得到两种酸式盐,该反应的离子方程式是____。
(6)一定条件下,向体积为2L的恒容密闭容器中充入1.2 mol CH4(g)和4.8 mol CO2(g),发生反应:CH4 (g)+3CO2 (g)![]() 2H2O(g)+4CO(g) ΔH>0。实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如右图。计算该条件下,此反应的
2H2O(g)+4CO(g) ΔH>0。实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如右图。计算该条件下,此反应的![]() H=______。
H=______。