题目内容
2.铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途.请回答以下问题:(1)Cu+基态核外电子排布式为1s22s22p63s23p63d10
(2)与OH-互为等电子体的一种分子为HF(填化学式).
(3)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图),a位置上Cl原子的杂化轨道类型为sp3.已知其中一种化合物的化学式为KCuCl3,另一种的化学式为K2CuCl3;
(4)Cu2O的熔点比Cu2S的高(填“高”或“低”),请解释原因由于氧离子的离子半径小于硫离子的离子半径,所以亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键,所以Cu2O的熔点比Cu2S的高
(5)一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为3:1;该晶体中,原子之间的作用力是金属键;
(6)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构为CaF2的结构相似,该晶体储氢后的化学式应为AuCu3H8.
(7)将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加少量FeSO4作催化剂,即发生反应,生成硫酸铜.其反应过程的第2步是:2Fe3++Cu═2Fe2++Cu2+,请写出其第l步反应的离子方程式4Fe2++O2+4H+=4Fe3++2H2O.

分析 (1)Cu的原子序数为29,失去1个电子后核外电子为28;
(2)与OH-互为等电子体的分子中含2个原子、价电子数为8;
(3)a位置上Cl原子形成2个单键,且Cl还有2对孤对电子;化合物的化学式为KCuCl3中Cu为+2价,则另一化合物中Cu为+1价;
(4)均为离子化合物,氧离子半径小,则离子键键能大;
(5)晶胞中Cu原子处于面心,Au原子处于顶点位置,利用均摊法计算晶胞中含有的原子个数来确定原子个数之比,金属晶体中存在金属键;
(6)由氟化钙的晶胞知,在CaF2晶胞中每个Ca2+连接4个氟离子,但在下面一个晶胞中又连接4个氟离子,所以其配位数为8;则每个氢原子连接3个铜原子、1个金原子,所以该晶胞中含有8个氢原子;
(7)向反应液中加少量FeSO4作催化剂,即发生反应,生成硫酸铜,结合第2步铁离子与Cu反应,可知第l步反应为亚铁离子与氧气反应生成铁离子.
解答 解:(1)Cu的原子序数为29,失去1个电子后核外电子为28,则Cu+基态核外电子排布式为1s22s22p63s23p63d10,故答案为:1s22s22p63s23p63d10;
(2)与OH-互为等电子体的分子中含2个原子、价电子数为8,则HF分子符合,故答案为:HF;
(3)a位置上Cl原子形成2个单键,且Cl还有2对孤对电子,可知Cl的杂化轨道类型为sp3,化合物的化学式为KCuCl3中Cu为+2价,则另一化合物中Cu为+1价,则化学式为K2CuCl3,故答案为:sp3;K2CuCl3;
(4)二者均为离子化合物,由于氧离子的离子半径小于硫离子的离子半径,所以亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键,所以Cu2O的熔点比Cu2S的高,
故答案为:高;由于氧离子的离子半径小于硫离子的离子半径,所以亚铜离子与氧离子形成的离子键强于亚铜离子与硫离子形成的离子键,所以Cu2O的熔点比Cu2S的高;
(5)在晶胞中Cu原子处于面心,Au原子处于顶点位置,所以该晶胞中含有铜原子个数=6×$\frac{1}{2}$=3,金原子个数=8×$\frac{1}{8}$=1,则该合金中Cu原子与Au原子数量之比为3:1,金属晶体中含有金属键;
故答案为:3:1;金属键;
(6)由氟化钙的晶胞知,在CaF2晶胞中每个Ca2+连接4个氟离子,但在下面一个晶胞中又连接4个氟离子,所以其配位数为8;则每个氢原子连接3个铜原子、1个金原子,所以该晶胞中含有8个氢原子,该晶体储氢后的化学式为,故答案为:AuCu3H8;
(7)向反应液中加少量FeSO4作催化剂,即发生反应,生成硫酸铜,结合第2步铁离子与Cu反应,可知第l步反应为亚铁离子与氧气反应生成铁离子,该离子反应为4Fe2++O2+4H+=4Fe3++2H2O,故答案为:4Fe2++O2+4H+=4Fe3++2H2O.
点评 本题考查较综合,涉及晶体结构及计算、金属及化合物的性质等,侧重物质结构与性质的考查,综合性较强,(6)为解答的难点,题目难度中等.

 智慧小复习系列答案
智慧小复习系列答案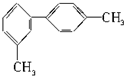
| A. | 分子中至少有6个碳原子处于同一平面上 | |
| B. | 分子中至少有8个碳原子处于同一平面上 | |
| C. | 分子中至少有10个碳原子处于同一平面上 | |
| D. | 分子中至少有14个碳原子处于同一平面上 |
| A. | 光照条件下,甲烷通入氯水中,发生了取代反应使黄绿色变浅 | |
| B. | 乙烯能使酸性高锰酸钾溶液褪色,也能使溴水褪色,两者反应原理一样 | |
| C. | 乙醛与新制氢氧化铜溶液混合好后,加热,得到砖红色沉淀 | |
| D. | 将一小粒钠投入盛有无水乙醇的小烧杯中,有气泡产生,比钠在水中的反应更剧烈 |
| A. | 氢氟酸具有强酸性,可用于蚀刻玻璃 | |
| B. | 碳具有还原性,一定条件下能将二氧化硅还原为硅 | |
| C. | BaCO3、BaSO4都难溶于水,可用作医疗上的钡餐 | |
| D. | 氧化铝具有很高的熔点,可用于制造熔融烧碱的坩埚 |

| A. | 该反应是取代反应 | |
| B. | 苯酚和羟基扁桃酸不是同系物 | |
| C. | 乙醛酸能使酸性KMnO4溶液褪色 | |
| D. | 1 mol羟基扁桃酸能与2 mol NaOH反应 |
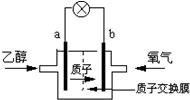
| A. | a极为电池的负极,乙醇被还原 | |
| B. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| C. | 电池正极的电极反应为:2H++O2+4e-=H2O | |
| D. | 电池工作时1mol乙醇被氧化时,就有12mol质子通过质子交换膜 |
①蒸馏 ②过滤 ③静置分液 ④萃取 ⑤通入过量的CO2 ⑥加入足量金属钠 ⑦加足量的NaOH溶液 ⑧加足量浓Br2水 ⑨加入乙酸与浓H2SO4混合液并加热.
| A. | ⑥⑤④③ | B. | ⑦①⑤③ | C. | ⑧②⑤③ | D. | ⑨①⑤③ |
| A. | 单位时间内生成n mo1 O2的同时生成2n mol NO2 | |
| B. | 混合气体的颜色不再改变 | |
| C. | 混合气体的压强不再改变的状态 | |
| D. | 混合气体的密度不再改变的状态 |
 .
. ,结构式为H-O-H.
,结构式为H-O-H.