题目内容
13.下列有关实验及现象、原理的描述正确的是( )| A. | 光照条件下,甲烷通入氯水中,发生了取代反应使黄绿色变浅 | |
| B. | 乙烯能使酸性高锰酸钾溶液褪色,也能使溴水褪色,两者反应原理一样 | |
| C. | 乙醛与新制氢氧化铜溶液混合好后,加热,得到砖红色沉淀 | |
| D. | 将一小粒钠投入盛有无水乙醇的小烧杯中,有气泡产生,比钠在水中的反应更剧烈 |
分析 A.氯气和水反应生成HCl、HClO,HClO不稳定,易分解,从而促进氯气和水反应;
B.乙烯能和溴发生加成反应,能被酸性高锰酸钾溶液氧化;
C.乙醛和新制氢氧化铜悬浊液发生氧化反应生成乙酸,同时生成氧化亚铜;
D.钠和乙醇反应较缓慢.
解答 解:A.氯气和水反应生成HCl、HClO,HClO不稳定,易分解,从而促进氯气和水反应,导致溶液颜色变浅,不是发生取代反应的原因,故A错误;
B.乙烯能和溴发生加成反应生成1,2-二溴乙烷,能被酸性高锰酸钾溶液氧化生成二氧化碳,二者反应原理不同,故B错误;
C.乙醛和新制氢氧化铜悬浊液发生氧化反应生成乙酸,同时生成砖红色沉淀氧化亚铜,该反应现象还可以检验醛基,故C正确;
D.钠与乙醇反应不如水反应剧烈,钠粒逐渐变小,缓缓产生气泡,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及官能团检验、烯烃性质、氯气的性质等知识点,明确物质的性质及反应原理是解本题关键,易错选项是B.

练习册系列答案
相关题目
4.0.1mol/L的碳酸氢钠溶液存在下列离子,其中离子浓度最小的是( )
| A. | Na+ | B. | H+ | C. | HCO3- | D. | OH- |
8.下列叙述中正确的是( )
| A. | 最外层为2个电子的原子都是金属原子 | |
| B. | 电子能量越低,其运动区域离核越近 | |
| C. | 每个电子层作为最外层时,最多可容纳的电子数均为8 | |
| D. | 从Li到F、从Na到Cl,元素的最高正化合价均呈现从+1到+7价的变化 |
5.有A、B、C三种金属,将A与B用导线联结起来,浸入电解质溶液中,B不易腐蚀.将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出.据此判断它们的活动性由强到弱的顺序是( )
| A. | B>A>C | B. | A>B>C | C. | A>C>B | D. | C>B>A |
3.在标准状况下将1.92g铜粉投入一定量浓HNO3中随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混和气体1.12L,则混和气体中NO的体积为( )
| A. | 112mL | B. | 1008mL | C. | 224mL | D. | 448mL |
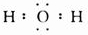
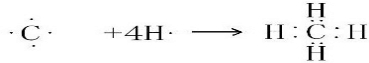 .
.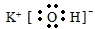 ②C(CH3)4的系统命名:2,2-二甲基丙烷.
②C(CH3)4的系统命名:2,2-二甲基丙烷.