题目内容
7.美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意如图,下列说法正确的是( )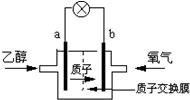
| A. | a极为电池的负极,乙醇被还原 | |
| B. | 电池工作时电子由b极沿导线经灯泡再到a极 | |
| C. | 电池正极的电极反应为:2H++O2+4e-=H2O | |
| D. | 电池工作时1mol乙醇被氧化时,就有12mol质子通过质子交换膜 |
分析 该燃料电池中,负极上乙醇失电子和水反应生成二氧化碳和氢离子,负极反应为C2H5OH+3H2O-12e-=2CO2+12H+,正极上氧气得电子和氢离子反应生成水,电极反应式为4H++O2+4e-═2H2O,以此解答该题.
解答 解:A.在燃料电池中,燃料乙醇在负极发生失电子的反应,氧气是在正极上发生得电子的反应,则a为负极,故A错误;
B.电池工作时,电流由正极经外电路流向负极,在该电池中由b极流向a极,故B错误;
C.在燃料电池中,正极上是氧气得电子的还原反应,在酸性电解质环境下,正极的电极反应为:4H++O2+4e-=2H2O,故C正确;
D.根据电池反应:C2H5OH+3O2=2CO2+3H2O,乙醇被氧化电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,则1mol乙醇被氧化失去12mol电子,所以1mol乙醇被氧化电路中转移12NA的电子,有12mol质子通过质子交换膜,故D正确;
故选CD.
点评 本题考查了原电池原理,明确正负极上发生的反应是解本题关键,难点是电极反应式的书写,注意:该交换膜为质子交换膜暗示溶液呈酸性.

练习册系列答案
相关题目
17.用化学用语表达下列微粒,错误的是( )
| A. | 氟离子的结构示意图: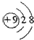 | |
| B. | 氮分子的电子式: | |
| C. | 水分子的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-H+ | |
| D. | C-14原子:${\;}_{6}^{14}$C |
15.我国科学家研制出一种催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2$\stackrel{催化剂}{→}$CO2+H2O.下列有关说法正确的是( )
| A. | 该反应为放热反应 | B. | CO2分子中的化学键为非极性键 | ||
| C. | HCHO分子中只含δ键不含π键 | D. | 设生成1.8gH2O消耗2.24L O2 |
12.下列气体的主要成分不是甲烷的是( )
| A. | 坑道气 | B. | 煤气 | C. | 天然气 | D. | 沼气 |
17.设NA为阿伏加德罗常数的值.下列有关物质结构的说法正确的是( )
| A. | 78gNa2O2晶体中所含阴、阳离子个数均为2NA | |
| B. | PCl3和H2O分子中所有原子的最外层都达到8电子稳定结构 | |
| C. | 1.8gD2O含有NA个中子 | |
| D. | 3.4g氨气中含有0.6NA个N-H键 |
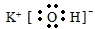 ②C(CH3)4的系统命名:2,2-二甲基丙烷.
②C(CH3)4的系统命名:2,2-二甲基丙烷.
 $\stackrel{反应②}{→}$X,
$\stackrel{反应②}{→}$X, .
. 甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.
甲醇燃料电池被认为是21世纪电动汽车最佳候选动力源.