题目内容
9.已知可逆反应2SO2+O2?2SO3,当生成2mol SO3时放出热量为Q,现将1mol SO2和0.5mol O2在相同条件下反应生成SO3放出的热量为Q1,则( )| A. | 2Q1=Q | B. | 2Q1<Q | C. | 2Q1>Q | D. | 无法判断 |
分析 根据可逆反应的特点可知,可逆反应是不能进行到底的反应,即反应后的体系中含有所有反应物和生成物,反应热与化学计量数成正比.
解答 解:若将 1mol SO2和0.5mol O2在相同条件下放入密闭容器发生反应,因2SO2+O2?2SO3是可逆反应,则 1mol SO2和0.5mol O2不会完全反应生成1molSO3,即生成SO3的量小于1mol,根据反应2SO2+O2?2SO3,当生成2mol SO3时放出热量为Q,生成1molSO3放出的热量为$\frac{1}{2}$Q,则生成小于1mol的 SO3 时放出的热量必小于$\frac{1}{2}$Q,即 Q1<$\frac{1}{2}$Q,2Q1<Q,
故选B.
点评 本题考查可逆反应与反应热间的关系,掌握可逆反应的特点是解答该题的关键,题目难度不大.

练习册系列答案
相关题目
19.生活中的一些问题常涉及化学知识.下列叙述中,不正确的是( )
| A. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| C. | 人造黄油里的反式脂肪酸对健康不利,它是液态植物油加氢时产生的 | |
| D. | 新制的氢氧化铜可以检验病人是否患有糖尿病 |
17.下列相关实验不能达到预期目的是( )
| 相关实验 | 预期目的 | |
| A | 将SO2通入溴水,溴水褪色 | 验证SO2的还原性 |
| B | 将氯水加入淀粉KI溶液中 | 验证Cl非金属性比I强 |
| C | 在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率. | 比较同周期金属元素的金属性强弱. |
| D | 利用电解质溶液的导电性装置,检测AlCl3溶液的导电性 | 证明AlCl3是离子化合物 |
| A. | A | B. | B | C. | C | D. | D |
4.X、Y、Z均是短周期元素,X、Y位于同一周期,X、Z的最低价离子分别为X2-和Z-,且Y+和Z-离子具有相同的电子层结构.下列说法正确的是( )
| A. | 原子最外层电子数:X>Y>Z | B. | 对应气态氢化物的稳定性:X>Z | ||
| C. | 离子半径:X2->Y+>Z- | D. | 原子序数:X>Y>Z |
14. 近年来,科学家合成了一种稳定的氢铝化合物Al2H6.Al2H6的球棍模型如图所示,它的熔点为150℃,可用作高能燃料或储氢材料.下列说法正确的是( )
近年来,科学家合成了一种稳定的氢铝化合物Al2H6.Al2H6的球棍模型如图所示,它的熔点为150℃,可用作高能燃料或储氢材料.下列说法正确的是( )
 近年来,科学家合成了一种稳定的氢铝化合物Al2H6.Al2H6的球棍模型如图所示,它的熔点为150℃,可用作高能燃料或储氢材料.下列说法正确的是( )
近年来,科学家合成了一种稳定的氢铝化合物Al2H6.Al2H6的球棍模型如图所示,它的熔点为150℃,可用作高能燃料或储氢材料.下列说法正确的是( )| A. | 1molAl2H6中约含有4.8×1024个σ键 | |
| B. | 60gAl2H6中含铝原子约为1.2×1023个 | |
| C. | Al2H6可以燃烧,产物为氧化铝和水 | |
| D. | Al2H6在固态时所形成的晶体是离子晶体 |
1.如图是研究铁钉腐蚀的装置图,下列说法正确的是( )
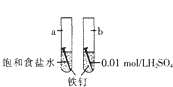

| A. | a是吸氧腐蚀,b是化学腐蚀 | |
| B. | a的负极反应时Fe-3e-═Fe3+ | |
| C. | a、b两处铁钉用导线联通有电流通过 | |
| D. | b前期发生析氢腐蚀,后期发生吸氧腐蚀 |
18.100g样品所消耗的溴的毫克数称为溴指数.溴指数越高,则说明样品中不饱和烃含量越高.我国石油工业一般利用恒定电流库仑分析法测定汽油的溴指数,利用电解产生的溴与不饱和烃反应,支持电解质为LiBr,溶剂仅含5%的水,其余为甲醇,苯与醋酸.下列有关说法正确的是( )
| A. | 在溶剂中提高苯的比例,能提高溶液的导电性 | |
| B. | 电解时阳极的电极反应式为2Br--2e-=Br2 | |
| C. | 电解时可用铁作阳极材料 | |
| D. | 汽油样品应加在阴极区 |
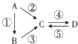 Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.
Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.