题目内容
14. 近年来,科学家合成了一种稳定的氢铝化合物Al2H6.Al2H6的球棍模型如图所示,它的熔点为150℃,可用作高能燃料或储氢材料.下列说法正确的是( )
近年来,科学家合成了一种稳定的氢铝化合物Al2H6.Al2H6的球棍模型如图所示,它的熔点为150℃,可用作高能燃料或储氢材料.下列说法正确的是( )| A. | 1molAl2H6中约含有4.8×1024个σ键 | |
| B. | 60gAl2H6中含铝原子约为1.2×1023个 | |
| C. | Al2H6可以燃烧,产物为氧化铝和水 | |
| D. | Al2H6在固态时所形成的晶体是离子晶体 |
分析 A.1mol Al2H6中含有6molAl-H键和1molAl-Alσ键;
B.1molAl2H6中含有2molAl,求出60gAl2H6的物质的量,就可求其所含Al的个数;
C.Al2H6作高能燃料可以燃烧根据原子个数守恒判断产物;
D.分子晶体熔沸点比较低,离子晶体熔沸点高,根据熔沸点可以判断时分子晶体.
解答 解:A.1mol Al2H6中含有6molAl-H键和1molAl-Alσ键,所含Al-Alσ键的个数:1mol×7NA=7×6.02×1023个,故A错误;
B.Al2H6的摩尔质量为:60g/mol,所以60gAl2H6的物质的量是1mol,1molAl2H6中含有2molAl,所以60g该物质中含Al个数2NA,约为1.2×1024个,故B错误;
C.Al2H6 燃烧的方程式:Al2H6+O2$\frac{\underline{\;点燃\;}}{\;}$Al2O3+H2O,故C正确;
D.Al2H6的熔点为150℃,熔点低,所以可以判断该物质在固体时是分子晶体,故D错误;
故选C.
点评 本题主要考查了氢铝化合物的结构和性质,解题时注意认真审题仔细分析其结构,题目难度中等.

练习册系列答案
相关题目
4.将 转变为
转变为 的方法为( )
的方法为( )
 转变为
转变为 的方法为( )
的方法为( )| A. | 与稀H2SO4共热后,加入足量的NaOH | |
| B. | 加入足量的稀盐酸共热 | |
| C. | 与稀H2SO4共热后,加入足量的NaHCO3 | |
| D. | 与足量的NaOH溶液共热后,再滴加过量的盐酸 |
2.关于如图所示装置(假设溶液体积不变),下列叙述正确的是( )
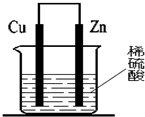

| A. | 电子从大量产生气泡的一极流出 | |
| B. | 反应一段时间后,溶液逐渐变为蓝色 | |
| C. | 逐渐溶解的一极上发生还原反应 | |
| D. | 烧杯内溶液中阳离子的物质的量浓度总和逐渐减小 |
9.已知可逆反应2SO2+O2?2SO3,当生成2mol SO3时放出热量为Q,现将1mol SO2和0.5mol O2在相同条件下反应生成SO3放出的热量为Q1,则( )
| A. | 2Q1=Q | B. | 2Q1<Q | C. | 2Q1>Q | D. | 无法判断 |
19.下列实验不能达到目的是( )
| A. | 用KSCN溶液检验Fe2+ | B. | 用湿润的红色石蕊试纸检验氨气 | ||
| C. | 用湿润的淀粉碘化钾试纸检验氯气 | D. | 用硝酸酸化的AgNO3溶液检验Cl- |
6.甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.已知:CH3OH(l)+O2(g)=CO(g)+2H2O(g)△H1=-443.64kJ•mol-12CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1下列说法或热化学方程式正确的是( )
| A. | CO的燃烧热为566.0 kJ•mol-1 | |
| B. | 2 mol CO和1 mol O2的总能量比2 mol CO2的总能量低 | |
| C. | 完全燃烧20g甲醇,生成二氧化碳和水蒸气时放出的热量为908.3 kJ | |
| D. | 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1453.28 kJ•mol-1 |
3.下列离子方程式正确的是( )
| A. | 向FeI2溶液中通入等物质的量的Cl2:2I-+Cl2═2Cl-+I2 | |
| B. | 用过量氨水吸收烟道气中的SO2:SO2+NH3•H2O═HSO3-+NH4+ | |
| C. | 向NaHSO4溶液中加入Ba(OH)2至中性:H++SO42-+Ba2++OH-═H2O+BaSO4↓ | |
| D. | 向AgCl饱和溶液中滴加Na2S溶液:2AgCl+S2-═Ag2S+2Cl- |
15.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率且不影响生成H2的总量,可向盐酸中加入适量的( )
| A. | CaCO3(固) | B. | NaCl溶液 | C. | KNO3溶液 | D. | CuSO4(固) |
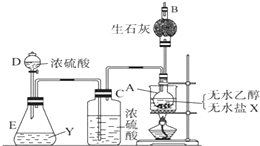 为证明乙醇分子中含有氧原子,现采用一套装置进行实验.试根据装置示意图、试剂及实验现象,回答有关问题.
为证明乙醇分子中含有氧原子,现采用一套装置进行实验.试根据装置示意图、试剂及实验现象,回答有关问题.