题目内容
【题目】已知亚硫酸钠在空气中能被氧气氧化生成硫酸钠。
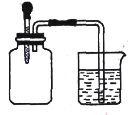
I. 甲同学设计两种方案来检验![]() 是否发生变质。
是否发生变质。
方案一:取样,加入稀盐酸有气泡生成,认为亚硫酸钠没有变质。
方案二:取样,加入氯化钡溶液有白色沉淀生成,认为亚硫酸钠完全变质。
请你对两方案做出评价:
方案一:_________(填“合理”或“不合理”),理由是_____________________。
方案二:_________(填“合理”或“不合理”),理由是____________________。
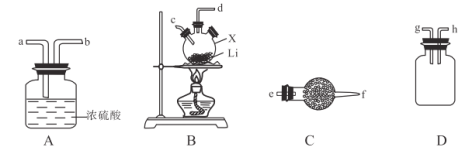
Ⅱ. 乙同学为了探究![]() 是否发生变质,设计如下实验测定
是否发生变质,设计如下实验测定![]() 溶液的实际浓度。
溶液的实际浓度。
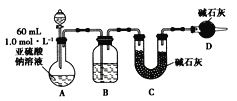
(1)①分液漏斗中应加入足量的________(填字母)。
a.浓硝酸 b.65%硫酸 c.浓盐酸
②装置B中盛装的试剂为_____________。
(2)实验前后测得装置C增重3.2g,则![]() 溶液实际的物质的量浓度为___________________(保留2位有效数字)。
溶液实际的物质的量浓度为___________________(保留2位有效数字)。
(3)该实验装置还存在一个明显的缺陷是________________。
【答案】不合理 亚硫酸钠部分变质时加入稀盐酸也会产生气泡 不合理 亚硫酸钠也能与氯化钡反应生成白色沉淀,故亚硫酸钠未变质或部分变质时也会产生白色沉淀 b 浓硫酸 0.83 mol·L-l 缺少一个驱赶残留二氧化硫气体的装置(或其他合理答案)
【解析】
装置A是制备二氧化硫气体,通过装置B干燥二氧化硫气体,用装置C吸收二氧化硫,装置D是防止空气中的水蒸气和二氧化碳干扰二氧化硫气体质量的测定,据此分析解答。
I.方案一、加入稀盐酸有气泡生成,证明溶液中含有亚硫酸钠,Na2SO3溶液可能没有变质,也可能部分变质,故答案为:不合理;亚硫酸钠部分变质时加入稀盐酸也会产生气泡;
方案二、亚硫酸钠、硫酸钠都能与氯化钡反应生成亚硫酸钡、硫酸钡白色沉淀,故亚硫酸钠溶液未变质、部分变质、全部变质时的现象相同,都会生成白色沉淀,故答案为:不合理;亚硫酸钠也能与氯化钡反应生成白色沉淀,故亚硫酸钠未变质或部分变质时也会产生白色沉淀;
Ⅱ、(1)①装置中A是制备二氧化硫气体,a.浓硝酸有挥发性,且浓硝酸有强氧化性,能把亚硫酸根离子氧化成硫酸根离子,反应不能放出二氧化硫气体,错误;b.65%硫酸与亚硫酸钠反应放出二氧化硫,正确;c.浓盐酸与亚硫酸钠反应放出二氧化硫,但混入氯化氢气体,会对实验造成干扰,错误,故答案为:b;
②装置B是干燥生成的二氧化硫气体,可以选用液态干燥剂浓硫酸,故答案为:浓硫酸;
(2)C装置增重3.2g,产生的n(SO2)=![]() =0.05 mol,所以n(Na2SO3)=0.05 mol,则c(Na2SO3)=
=0.05 mol,所以n(Na2SO3)=0.05 mol,则c(Na2SO3)=![]() =0.83 mol·L-1,故答案为:0.83 mol·L-1;
=0.83 mol·L-1,故答案为:0.83 mol·L-1;
(3)二氧化硫会储存在某些装置中导致碱石灰吸收的二氧化硫减少,造成偏差,所以存在的缺陷是:缺少一个驱赶残留二氧化硫气体的装置,故答案为:缺少一个驱赶残留二氧化硫气体的装置。

 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案