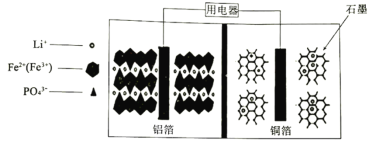
题目内容
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)在生产和生活中有重要用途。已知Na2S2O3·5H2O遇酸立即分解:S2O32-+2H+=S↓+SO2↑+H2O。某研究小组在实验室模拟工业上硫化碱法制备Na2S2O3·5H2O流程如图所示:

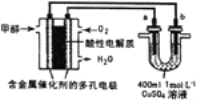
吸硫过程实验装置如图所示:

回答下列问题:
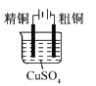
(1)y仪器的名称________________。
(2)关闭K1,打开K2,反应开始,此时B装置的作用是________________。
(3)写出C装置中反应的离子方程式________________。
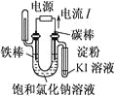
(4)装置D的作用是检验装置C中SO2的吸收效率,D中试剂是________________,表明SO2吸收效率低的实验现象是D中溶液________________。
(5)实验结束后,关闭K2,打开K1。玻璃液封管x中所盛液体最好为____________(填序号)。
A.NaOH溶液 B.浓硫酸 C.饱和NaHSO3溶液
(6)从滤液中获得较多Na2S2O3·5H2O晶体的实验操作依次为:________________,________________,过滤,洗涤,干燥。
(7)请设计实验检测制得的Na2S2O3·5H2O产品中是否含有Na2SO4杂质,简要说明实验操作及结论________________。
【答案】三颈烧瓶(或三口烧瓶) 安全瓶(或防止倒吸) 2S2-+CO32-+4SO2=3S2O32-+CO2(或2S2-+2CO32-+4SO2+H2O=3S2O32-+2HCO3-) 品红(或溴水、KMnO4溶液) 颜色很快褪去 A 蒸发浓缩(或加热浓缩) 冷却结晶 取少量产品溶于足量稀盐酸中,静置,取上层清液(或过滤后取滤液),滴加BaCl2溶液,若出现白色沉淀则说明Na2S2O3·5H2O晶体中含有Na2SO4杂质,若无现象则说明Na2S2O3·5H2O晶体中不含Na2SO4杂质
【解析】
(1)根据装置图所示,仪器y的名称为三颈烧瓶(或三口烧瓶);
(2)关闭K1,打开K2,SO2进入装置C中反应导致实验装置内部压强减小会引起倒吸,因此装置B的作用是安全瓶(或防止倒吸);
(3)二氧化硫与硫化钠、碳酸钠反应生成硫代硫酸钠和二氧化碳(或硫代硫酸钠和碳酸氢钠),则发生的离子反应方程式为:2S2-+CO32-+4SO2=3S2O32-+CO2(或2S2-+2CO32-+4SO2+H2O=3S2O32-+2HCO3-);
(4)装置D的作用是检验装置C中SO2的吸收效率,利用SO2的还原性和漂白性,结合溶液的颜色变化快慢分析SO2的吸收效率,则D中试剂可以是品红(或溴水、KMnO4溶液等具有强氧化性的有色物质),若D中试剂颜色褪去缓慢,说明C中产生的气体中SO2的含量低,C中反应对SO2的吸收效率高,若D中试剂颜色快速褪去,说明C中产生的气体中SO2的含量高,C中的反应对SO2的吸收效率低;
(5)实验结束后,装置B中含有多余未反应的SO2,SO2属于大气污染物,不能直接排放到空气中,需要吸收处理,
A.NaOH溶液可与SO2反应,可以除去多余的SO2,故A符合题意;
B.浓硫酸与SO2不反应,无法除去多余的SO2,故B不符合题意;
C.饱和NaHSO3溶液与SO2不反应,无法除去多余的SO2,故C不符合题意;
答案选A;
(6)从滤液中获得较多Na2S2O3·5H2O晶体的实验操作依次为:蒸发浓缩(或加热浓缩),冷却结晶,过滤,洗涤,干燥;
(7)检测制得的Na2S2O3·5H2O产品中是否含有Na2SO4杂质即为检验SO42-,实验操作为:取少量产品溶于足量稀盐酸中,静置,取上层清液(或过滤后取滤液),滴加BaCl2溶液,若出现白色沉淀则说明Na2S2O3·5H2O晶体中含有Na2SO4杂质,若无现象则说明Na2S2O3·5H2O晶体中不含Na2SO4杂质。

 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案【题目】下列各选项中,物质之间通过一步反应就能实现如图所示变化的是( )
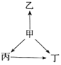
选项 | 甲 | 乙 | 丙 | 丁 |
A | Al | AlCl3 | Al2O3 | NaAlO2 |
B | S | H2S | SO2 | SO3 |
C | Na | Na2O | NaOH | Na2O2 |
D | N2 | NH3 | NO | NO2 |
A. AB. BC. CD. D